Sejarah Bromo, Struktur, Konfigurasi Elektronik, Hartanah, Kegunaan

- 2361
- 253
- Erick Krajcik
Dia bromin Ia adalah elemen bukan logam yang dimiliki oleh kumpulan halogen, kumpulan 17 (viia) dari jadual berkala. Simbol kimianya adalah br. Ia dibentangkan sebagai molekul diatomik, yang atomnya disatukan oleh ikatan kovalen, jadi formula molekul diberikan2.
Tidak seperti fluorida dan klorin, bromin dalam keadaan terestrial bukan gas tetapi cecair coklat kemerahan (imej yang lebih rendah). Ia merokok, dan ia bersama -sama dengan merkuri, satu -satunya elemen cecair. Di bawahnya, iodin, walaupun warnanya semakin meningkat dan menjadi ungu, dapat mengkristal dalam pepejal yang tidak menentu.
 Botol dengan bromin cecair tulen. Sumber: Hi-Res Imej Elemen Kimia [CC oleh 3.0 (https: // creativeCommons.Org/lesen/oleh/3.0)]
Botol dengan bromin cecair tulen. Sumber: Hi-Res Imej Elemen Kimia [CC oleh 3.0 (https: // creativeCommons.Org/lesen/oleh/3.0)] Bromo ditemui, secara bebas, pada tahun 1825 oleh Carl Löwig, yang belajar di bawah arahan ahli kimia Jerman Leopold Gmelin; Dan pada tahun 1826, oleh ahli kimia Perancis Antoine-Jerome Ballard. Walau bagaimanapun, penerbitan hasil eksperimen balard mendahului Löwig.
Bromo adalah elemen ke -62 yang paling banyak di bumi, diedarkan dalam kepekatan rendah oleh korteks bumi. Di laut, kepekatan purata adalah 65 ppm. Tubuh manusia mengandungi bromin 0.0004 %, tidak pasti mengetahui fungsinya.
Unsur ini dieksploitasi secara komersil di Salmuelas atau tempat -tempat yang oleh keadaan khas adalah garam yang tinggi; Sebagai contoh, Laut Mati, yang mana perairan wilayah jiran, tepu dengan garam berkumpul.
Ia adalah elemen yang menghakis yang mampu menyerang logam, seperti platinum dan paladium. Dibubarkan di dalam air, bromin juga boleh melakukan tindakan menghakisnya pada tisu manusia, memburukkan lagi keadaan kerana asid bromhyteric dapat dihasilkan. Mengenai ketoksikannya, ia boleh menyebabkan kerosakan penting kepada organ, seperti hati, buah pinggang, paru -paru dan perut.
Bromin sangat berbahaya di atmosfera, yang menjadi 40-100 kali lebih merosakkan untuk lapisan ozon daripada klorin. Separuh daripada kehilangan lapisan ozon di Antartika dihasilkan oleh tindak balas yang berkaitan dengan bromometil, sebatian yang digunakan sebagai fumigant.
Ia mempunyai banyak kegunaan, seperti: retarder kebakaran, ejen pemutihan, disinfektan permukaan, bahan api bahan api, perantara dalam pembuatan sedatif, dalam pembuatan bahan kimia organik, dll.
[TOC]
Sejarah
Carl Löwig bekerja
Bromo ditemui secara bebas dan hampir serentak oleh Carl Jacob Löwig, seorang ahli kimia Jerman pada tahun 1825, dan oleh Antoine Balard, seorang ahli kimia Perancis pada tahun 1826.
Carl Löwig, seorang murid ahli kimia Jerman Leopold Gmelin, mengumpul air dari musim bunga Kreuznach yang buruk dan menambah klorin; Selepas penambahan eter, dia menggerakkan campuran cecair.
Kemudian, eter dipisahkan oleh penyulingan dan memusatkannya dengan penyejatan. Akibatnya, dia memperoleh bahan coklat kemerahan, yang merupakan bromin.
Antoine Balard bekerja
Balard, sebaliknya, menggunakan abu alga coklat. Oleh itu, bromo yang dikeluarkan, klorin melewati bahan berair yang tertakluk kepada pengekstrakan, di mana magnesium bromida, mgbr hadir2.
Seterusnya, bahan itu disuling dengan kehadiran asid dioksida mangan dan sulfurik, menghasilkan wap merah yang dipendekkan menjadi cecair gelap. Batalard menyangka ia adalah elemen baru dan memanggilnya murida, berasal dari perkataan Latin muria, yang mana air garam itu ditetapkan.
Ia boleh melayani anda: perkara hidup: konsep, ciri dan contohTelah dinyatakan bahawa Balard menukar nama murida kepada Brôme dengan cadangan Anglada atau Gay-Lussac, berdasarkan fakta bahawa Brôme bermaksud pestilen, yang mentakrifkan bau elemen yang ditemui.
Hasilnya diterbitkan oleh Belard di Annales of Chemie dan Physique, sebelum Löwig menerbitkan sendiri.
Hanya dari tahun 1858, bromin dihasilkan dalam kuantiti penting; tahun di mana deposit garam stassfurt ditemui dan dieksploitasi, memperoleh bromin.
Struktur dan konfigurasi elektronik Bromo
Molekul
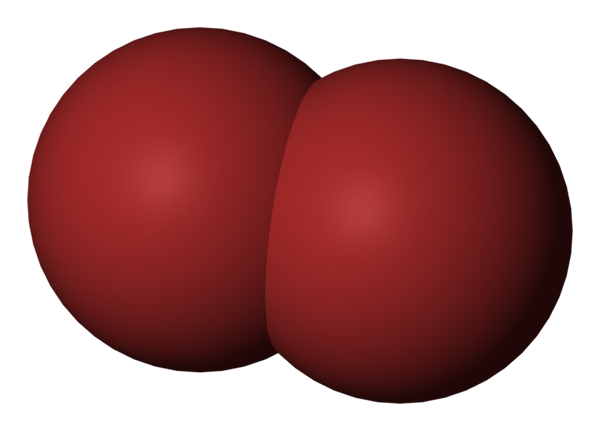 Molekul BR2. Sumber: Benjah-bmm27 [domain awam].
Molekul BR2. Sumber: Benjah-bmm27 [domain awam]. Di bahagian atas imej molekul bromin ditunjukkan, BR2, Dengan model pengisian yang padat. Sebenarnya, terdapat ikatan kovalen yang mudah antara dua atom bromin, BR-BR.
Menjadi molekul diatomik dan homogen, ia tidak mempunyai momen dipole kekal dan hanya dapat berinteraksi dengan orang lain dari jenis yang sama melalui daya penyebaran London.
Inilah sebab mengapa cecair kemerahan anda merokok; Dalam molekul BR2, Walaupun mereka agak berat, daya intermolecular mereka membuat mereka lemah dikaitkan.
Bromo kurang elektronegatif daripada klorin, dan oleh itu, memberi kesan tarikan yang lebih rendah pada elektron lapisan Valencia. Akibatnya, ia memerlukan kurang tenaga untuk bergerak tahap tenaga yang lebih tinggi, menyerap foton hijau, dan mencerminkan warna kemerahan.
Kristal
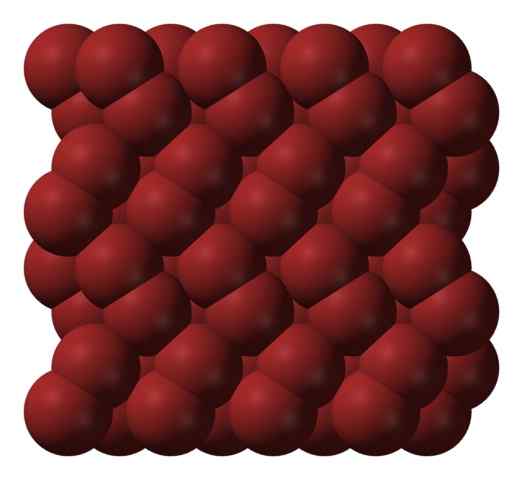 Struktur kristal Bromo. Sumber: Ben Mills [Domain Awam].
Struktur kristal Bromo. Sumber: Ben Mills [Domain Awam]. Dalam fasa gas, molekul BR2 Mereka memisahkan diri sehingga terdapat interaksi yang efisien di antara mereka. Walau bagaimanapun, di bawah titik leburnya, bromin boleh dibekukan dalam kristal ortorrombik kemerahan (imej unggul).
Perhatikan bagaimana molekul br2 Mereka diposisikan dengan teratur sedemikian rupa sehingga mereka kelihatan "cacing bromin". Di sini dan pada suhu ini (t < -7,2°C), las fuerzas de dispersión son suficientes para que las vibraciones de las moléculas no desmoronen el cristal en el acto; pero aún así, varias de ellas sublimarán constantemente.
Lapisan dan Pengoksidaan Valencia
Konfigurasi bromin elektronik adalah:
[AR] 3D104s2 4p5
Menjadi 3d104s2 4p5 lapisan valensinya (walaupun orbital 3d10 Tidak mempunyai keunggulan dalam tindak balas kimia anda). Elektron orbital 4s dan 4p adalah yang paling luar dan menambah sejumlah 7, hanya satu elektron untuk melengkapkan oktet Valencia.
Dari konfigurasi ini, keadaan pengoksidaan yang mungkin dapat disimpulkan untuk bromin: -1, jika keuntungan elektron menjadi isolektronik kepada Kripton; +1, seperti 3d104s2 4p4; +3, +4 dan +5, kehilangan semua elektron orbital 4p ([AR] 3D104s24p0); dan +7, berjalan tanpa elektron dalam 4S orbital ([AR] 3D104s04p0).
Sifat
Penampilan fizikal
Cecair kemerahan coklat gelap kecil. Ia didapati bersifat sebagai molekul diatom, dengan atom bersatu dengan ikatan kovalen. Bromo adalah cecair yang lebih padat daripada air dan tenggelam ke dalamnya.
Boleh melayani anda: radio: struktur, sifat, kegunaan, mendapatkanBerat atom
79,904 g/mol.
Nombor atom
35.
Bau
Asap ekar, mencekik dan menjengkelkan.
Takat lebur
-7.2 ºC.
Takat didih
58.8 ºC.
Ketumpatan (Br2) cecair
3,1028 g/cm3
Kelarutan air
33.6 g/l A 25 ° C. Kelarutan bromin dalam air adalah rendah dan cenderung meningkat dengan mengurangkan suhu; tingkah laku yang serupa dengan gas lain.
Kelarutan
Bebas larut dalam alkohol, eter, kloroform, karbon tetraklorida, karbon disulfida, dan asid hidroklorik pekat. Larut dalam pelarut bukan polar dan beberapa kutub seperti alkohol, asid sulfurik dan dalam banyak pelarut halogenasi.
Triple Point
265.9 K pada 5.8 kPa.
Titik kritikal
588 K pada 10.34 MPa.
Haba Fusion (BR2)
10,571 kJ/mol.
Haba pengewapan (BR2)
29.96 kJ/mol.
Kapasiti kalori molar (BR2)
75.69 kJ/mol.
Tekanan wap
Pada suhu 270 k, 10 kPa.
Suhu sendiri
Tidak mudah terbakar.
titik pencucuhan
113 ºC.
Suhu penyimpanan
2 hingga 8 ºC.
Ketegangan permukaan
40.9 mn/m A 25 ºC.
Ambang bau
0.05 - 3.5 ppm. 0.39 mg/m3
Indeks Pembiasan (ηd)
1,6083 hingga 20 ºC, dan 1,6478 hingga 25 ºC.
Elektronegativiti
2.96 pada skala Pauling.
Tenaga pengionan
- Tahap Pertama: 1.139.9 kJ/mol.
- Tahap Kedua: 2.103 kJ/mol.
- Tahap Ketiga: 3.470 kJ/mol.
Radio atom
120 malam.
Radio Covalent
120.3 petang.
Radio Van der Waals
185 petang.
Reaktiviti
Ia kurang reaktif daripada klorin, tetapi lebih reaktif daripada yodium. Ia adalah oksidan yang kurang kuat daripada klorin dan lebih kuat daripada yodium. Ia juga merupakan ejen pengurangan yang lebih lemah daripada yodium, tetapi lebih kuat daripada klorin.
Wap klorin sangat menghakis untuk banyak bahan dan tisu manusia. Ia menyerang banyak elemen logam, termasuk platinum dan paladium; Tetapi ia tidak menyerang, nikel, magnesium, besi, zink, dan di bawah 300 ºC sama ada ke natrium.
Bromo di dalam air mengalami perubahan dan berubah menjadi bromida. Ia juga boleh wujud sebagai bromat (bro3-), Bergantung pada pH cecair.
Oleh kerana tindakan pengoksidaannya, bromin dapat menyebabkan pelepasan radikal bebas oksigen. Ini adalah oksidan yang kuat dan boleh menyebabkan kerosakan tisu. Juga, bromin boleh menghasilkan pencucuhan spontan apabila digabungkan dengan kalium, fosforus atau timah.
Aplikasi
Bahan tambahan petrol
Ethylene dibromide digunakan untuk menghapuskan kemungkinan deposit plumbum dalam enjin kereta. Selepas pembakaran petrol, yang menggunakan plumbum sebagai bahan tambahan, bromin digabungkan dengan membawa kepada bentuk bromida plumbum, gas yang tidak menentu yang diusir oleh tiub ekzos.
Walaupun bromin menghapuskan pendahuluan dari petrol, tindakan merosakkannya pada lapisan ozon sangat kuat, itulah sebabnya ia dibuang untuk aplikasi ini.
Racun perosak
Methylene atau bromometil bromida digunakan sebagai racun perosak untuk membersihkan tanah, terutamanya untuk menghapuskan nematoda parasit, seperti anylostome.
Walau bagaimanapun, penggunaan kebanyakan sebatian yang mengandungi bromin telah dibuang, sekali lagi, merosakkan lapisan ozon.
Kawalan penerbitan merkuri
Bromo digunakan di beberapa tumbuhan untuk mengurangkan pelepasan merkuri, logam yang sangat toksik.
Boleh melayani anda: gravimetri: analisis gravimetrik, kaedah, kegunaan dan contohFotografi
Bromida Perak, sebagai tambahan kepada perak yoduro dan perak klorida, digunakan sebagai sebatian sensitif ringan dalam emulsi fotografi.
Tindakan terapeutik
Potassium bromide, serta lithium bromide, digunakan sebagai sedatif umum pada abad ke -19 dan permulaan abad kedua puluh. Garam mudah masih digunakan di beberapa negara seperti anticonvulsions.
Walau bagaimanapun, FDA Amerika Syarikat tidak meluluskan penggunaan bromin untuk rawatan penyakit hari ini.
Retarder kebakaran
Bromin diubah oleh api ke dalam asid bromhoric, yang mengganggu tindak balas pengoksidaan yang berlaku semasa api, dan menghasilkan kepupusannya. Polimer mengandungi bromin digunakan untuk membuat resin retarding api.
Aditif makanan
Kesan Bromat Potassium ke Tepung telah ditambah untuk memperbaiki memasaknya.
Reagen kimia dan perantara
Hidrogen bromida digunakan sebagai ejen pengurangan dan pemangkin untuk tindak balas organik. Bromo digunakan sebagai perantara kimia dalam pembuatan ubat, cecair hidraulik, agen penyejuk, dehumidifier, dan persediaan untuk mengundurkan rambut.
Ia juga dapat digunakan dalam penjelasan cecair penggerudian yang baik, produk untuk pembasmian kuman air, agen putih, disinfektan permukaan, pewarna, bahan bakar bahan bakar, dll.
Tindakan biologi
Kajian yang dijalankan pada tahun 2014 menunjukkan bahawa bromin adalah cofactor yang diperlukan untuk biosintesis kolagen IV, yang menjadikan bromin sebagai elemen penting untuk perkembangan tisu haiwan. Walau bagaimanapun, tidak ada maklumat mengenai akibat dari defisit unsur.
Di mana ia berada
Bromo diekstrak secara komersial dari lombong garam dan telaga salmuelas yang mendalam yang terdapat di negeri Arkansas, dan di Tasik Salty Besar Utah, baik di Amerika Syarikat. Air garam terakhir ini mempunyai kepekatan bromin 0.5 %.
Untuk mengekstrak bromin.
Laut Mati, di sempadan antara Jordan dan Israel, adalah laut tertutup yang berada di bawah paras laut, yang menjadikannya kepekatan garam yang sangat tinggi.
Bromo dan Potassa diperolehi secara komersil di sana, dengan penyejatan air dengan garam yang tinggi di Laut Mati. Di laut ini kepekatan bromin dapat mencapai 5 g/l.
Ia juga terdapat dalam kepekatan tinggi di beberapa mata air panas. Sebagai contoh, Bominita adalah mineral bromida perak yang terdapat di Bolivia dan Mexico.
Risiko
Bromin dalam keadaan cair adalah menghakis untuk tisu manusia. Tetapi bahaya terbesar bagi manusia berasal dari wap bromin dan penyedutan.
Bernafas dalam persekitaran dengan kepekatan bromin 11-23 mg/m3 Ia menghasilkan kejutan yang teruk. Kepekatan 30-60 mg/m3 Ia sangat berbahaya. Sementara itu, kepekatan 200 mg boleh membawa maut.
Rujukan
- Shiver & Atkins. (2008). Kimia bukan organik. (Edisi Keempat). MC Graw Hill.
- Pusat Kebangsaan Maklumat Bioteknologi. (2019). Bromin. Pangkalan data PUBCHEM. CID = 23968. Pulih dari: pubchem.NCBI.NLM.NIH.Gov
- Ross Rachel. (8 Februari 2017). Fakta mengenai Bromine. Pulih dari: Livescience.com
- Wikipedia. (2019). Borax. Diperoleh dari: dalam.Wikipedia.org
- Lentech b. V. (2019). Bromin. Pulih dari: lentech.com

