Struktur, Kekuatan Kalium Bromide (KBR), Kegunaan, Kegunaan Potassium
- 1790
- 486
- Ms. Edgar Carroll
Dia Potassium bromide Ia adalah garam bukan organik yang formula kimianya adalah KBR. Ia dibentuk oleh kesatuan elektrostatik anion bromida, BR-, Dan kation kalium, k+, dalam bahagian 1: 1; iaitu, kita mempunyai jumlah yang sama dengan BR- Sehingga k+ Dalam kristal KBR.
Kalium bromida adalah garam putih atau kristal yang padat, ia tidak berbau, sangat larut dalam air, dan sedikit larut dalam etanol dan etanol. Ia digunakan pada bahagian terakhir abad ke -19 dan kebanyakan abad kedua puluh dalam rawatan epilepsi dan sebagai penenang.
Sehingga tahun 1975 ia terus dijual dengan bebas, tahun di mana penggunaannya menurun disebabkan oleh kesan toksik yang dihasilkan pada pesakit. Pada masa ini ia masih digunakan dalam beberapa spesies haiwan dalam rawatan sawan, walaupun dari tahun 1912 ia digantikan oleh natrium phenobarbital.
Potassium bromida digunakan dalam kajian optik yang sepadan dengan rantau inframerah berdekatan spektrum elektromagnetik. Ia juga berfungsi sebagai bahan yang digunakan dalam bidang fotografi.
[TOC]
Jenis pautan
Potassium Bromide adalah garam binari, produk gabungan atom bromin dengan keadaan pengoksidaan -1, dengan atom kalium dengan keadaan pengoksidaan +1. Oleh itu, tarikan elektrik antara Ion BR ditubuhkan- Dan k ion+.
Interaksi elektrik atau elektrostatik jenis ini dikenali sebagai ikatan ionik, yang memisahkan apabila garam kalium bromida larut di dalam air, melepaskan ion k+ dan br-.
Ion ini hancur oleh pemilik air.
Struktur Potassium Bromide
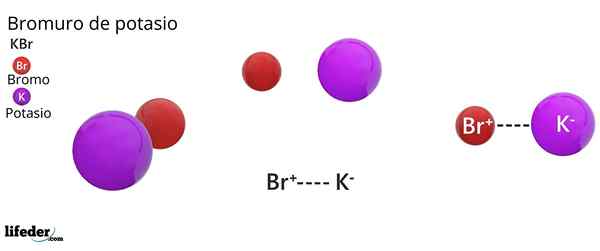
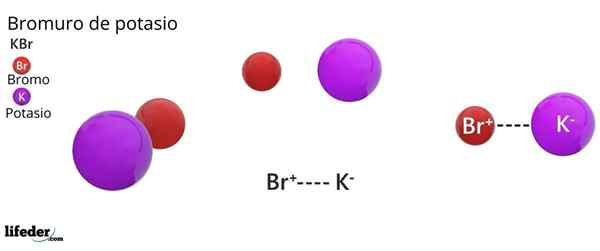
 Struktur kristal fcc kbr: sfera coklat sesuai dengan br-, manakala sfera violet sesuai dengan kation k+
Struktur kristal fcc kbr: sfera coklat sesuai dengan br-, manakala sfera violet sesuai dengan kation k+ Potassium Bromide membentangkan struktur kristal padu yang berpusat di muka (FCC) Kubik berpusatkan muka), sama dengan yang diperhatikan dalam natrium klorida.
Boleh melayani anda: faraday constantDalam struktur ini, setiap anion br- Ia dihubungkan atau diselaraskan dengan enam kasi+, Dan pada gilirannya, masing -masing k+ Ia mempunyai enam br- Sebagai jiran dalam rangkaian kristal.
Nomenclature
Potassium bromide diklasifikasikan sebagai halogenida logam halida atau alkali. Nama -nama garam ini dibina dengan menghapuskan huruf akhir nama halogen (klorin, bromin, yodium, fluorin dan astato), kecuali fluorida, dan menggantikan huruf akhir dengan akhiran -uro. Nama logam ditulis di bawah tanpa pengubahsuaian.
Sebagai contoh: natrium klorida, kalium iodida, kalsium fluorida, dll. Itulah sebabnya KBR dipanggil kalium bromida atau kalium bromida (mengikut tatanama tradisional).
Ciri -ciri Bromide Potassium
 Cakera jam dengan granul kbr. Sumber: Walkerma melalui Wikipedia.
Cakera jam dengan granul kbr. Sumber: Walkerma melalui Wikipedia. Penampilan fizikal
Kaca tanpa warna, kristal atau putih.
Bau
Lavatory
Rasa
Pada kepekatan yang tinggi ia mempunyai rasa pahit dan pedas.
Jisim molar
119.02 g/mol
Ketumpatan
2.74 g/cm3 pada 25 ºC
Takat lebur
734 ºC
Takat didih
1435 ºC
Kelarutan air
535 g/l A 0 ºC
678 g/l A 25 ºC
1020 g/l 100 ºC
1 gram garam dibubarkan dalam 1 ml air mendidih, yang menunjukkan bahawa ia sangat larut dalam air.
Kelarutan dalam gliserol
217 g/l
1 gram kalium bromida larut dalam 4.6 ml gliserol.
Kelarutan etanol
47.6 g/l A 80 ºC.
1 gram kalium bromida larut dalam 250 ml etanol.
Ketumpatan wap
7.14 dalam hubungan udara diambil sebagai unit.
Kestabilan
Stabil jika disimpan di bawah syarat yang disyorkan. Tidak serasi dengan ejen pengoksidaan, asid kuat, trifluorida bromin dan bromin.
Penguraian
Apabila dipanaskan untuk penguraian memancarkan produk yang berbahaya, seperti hidrogen bromida dan kalium oksida.
Boleh melayani anda: Konfigurasi elektronik kernel: Pembinaan, contohIndeks Pembiasan (ND)
1.559
Ph
Dalam larutan berair menghasilkan pH neutral, sekitar 7.
titik pencucuhan
1435 ºC
Pembubaran dan kereaktifan
Dalam larutan berair, KBR sepenuhnya dipisahkan untuk menyebabkan penyelesaian pH neutral.
Garam adalah sumber bromida yang boleh digunakan untuk pengeluaran bromida perak, AGBR, kompaun yang digunakan dalam pembangunan gambar:
KBR (AC) +AGNO3 (AC) → AGBR (s) +KNO3 (Ac)
Juga, KBR adalah ejen pengurangan yang lemah, tidak serasi dengan merkuri dan garam perak. Menghasilkan reaksi ganas dengan trifluorida bromin. Boleh bertindak balas dengan banyak garam, alkaloid dan kanji.
Ia juga bertindak balas dengan asid, contohnya, dengan asid sulfurik pekat, melepaskan bromida hidrogen.
Aplikasi
Rawatan epilepsi dan sawan
Ciri -ciri antikonvulsif dari kalium bromida pertama kali didedahkan oleh Sir Charles Locock, pada mesyuarat Perubatan Diraja dan Persatuan Chirurgical pada tahun 1857, yang mempromosikan penggunaannya dalam rawatan epilepsi.
Potassium Bromide digunakan sebagai ubat keutamaan dalam rawatan epilepsi dan sebagai sedatif sehingga tahun 1912, ketika natrium phenobarbital diumumkan.
Walaupun begitu, ia terus digunakan sebagai pelengkap kepada natrium phenobarbital dalam rawatan kejang epilepsi.
Pada tahun 1975, disebabkan oleh watak toksiknya, fda u.S. (Pentadbiran Makanan & Dadah) memutuskan untuk tidak mengesyorkan penggunaan kalium bromida, baik pada manusia dan haiwan. Walau bagaimanapun, sesetengah negara terus mentadbirnya.
Kalium bromida digunakan sebagai hipnosis dan sedatif dalam lembu, kuda, kambing dan babi. Ia juga digunakan dalam rawatan kolik dan tetania dalam kuda, dan dalam rawatan sawan pada anjing.
Optik inframerah
Oleh kerana ketelusan bromida kalium dalam pelbagai panjang gelombang antara cahaya ultraviolet dan inframerah berhampiran, ia digunakan sebagai komponen tingkap untuk beberapa radiasi elektromagnet, terutamanya radiasi inframerah.
Boleh melayani anda: osmolarityBeberapa teknik digunakan dalam hal ini. Salah satu daripada mereka terdiri daripada penjelasan dua cakera kristal kalium bromida, meletakkan filem bahan yang akan dianalisis dalam inframerah dalam album. Kajian dijalankan di inframerah berhampiran antara 780 nm dan 3000 nm.
Fotografi
 KBR adalah sebahagian daripada bahan yang digunakan untuk memproses gambar pertama abad kedua puluh
KBR adalah sebahagian daripada bahan yang digunakan untuk memproses gambar pertama abad kedua puluh Potassium Bromide mempunyai banyak kegunaan dan aplikasi dalam fotografi, contohnya: ia telah digunakan untuk merumuskan pemaju fotografi, dalam pembuatan filem fotografi, sebagai tebal filem, dan sebagai peluntur warna dalam warna.
Ia digunakan dalam peningkatan pembezaan antara kristal halida perak yang terdedah dan tidak terdedah, dalam peningkatan ketumpatan percetakan negatif nipis, dan sebagai halogenida sekunder, digabungkan dengan iodida, untuk pemprosesan kertas negatif di atas kertas.
Ia juga telah digunakan dalam kombinasi dengan merkuri bichloride, tembaga sulfat atau kalium ferricianurio dalam peluntur fotografi. Ia juga berfungsi sebagai pembatas dalam pemaju alkali yang digunakan untuk plat gelatin dan kertas pembangunan.
Analisis kimia
KBR digunakan dalam menentukan penilaian tembaga dan perak, dalam analisis polarografi India, kadmium dan arsenik.
Kegunaan lain
Ia digunakan dalam proses ukiran litografi, dalam pemprosesan minyak, dalam penstabilan haba nilon, dalam pembuatan gentian, dan akhirnya dalam pembuatan sabun khas.
Rujukan
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (8th ed.). Pembelajaran Cengage.
- Shiver & Atkins. (2008). Kimia bukan organik. (Edisi Keempat). MC Graw Hill.
- Hari, r., & Underwood, a. (1986). Kimia Analisis Kuantitatif (Kelima ed.). Pearson Prentice Hall.
- Wikipedia. (2020). Potassium bromide. Diperoleh dari: dalam.Wikipedia.org
- Pusat Kebangsaan Maklumat Bioteknologi. (2021). Potassium bromide. Ringkasan Pubchem Comunund untuk CID 253877. Pulih dari: pubchem.NCBI.NLM.NIH.Gov
- EMEA. (1999). Bromide, Garam Potassium: Laporan Ringkasan. [Pdf]. Pulih dari: EMA.Eropah.EU
- Sevier b.V. (2020). Potassium bromide. Scientedirect. Diperoleh dari: Scientedirect.com

