Asid lemah
- 1542
- 388
- Erick Krajcik
 Contoh asid lemah
Contoh asid lemah Apa itu asid lemah?
Asid lemah adalah satu larutan berair mempunyai sedikit keupayaan untuk memisahkan hidrogen (h+) dan dalam asas konjugasi yang sepadan. Tidak seperti asid yang kuat, yang pemisahannya selesai (100%) dan asid yang tidak dapat dipulihkan, asid lemah hampir tidak dipisahkan dan boleh diterbalikkan.
Oleh itu, asid lemah menjana kurang hones h+ Di dalam air yang diharapkan. Antara asid lemah yang paling mewakili kita mempunyai asid asetik, komponen utama cuka, yang kira -kira dalam 0.5 % dalam keadaan biasa.
Ini bermakna bahawa bahagian terbesar larutan asid asetik di dalam air, seperti cuka memasak 5%, berada dalam bentuk yang tidak diselaraskan (CH3COOH); Walaupun sebahagian kecil dijumpai sebagai asas konjugasi (pilih3COO-), disertakan dengan ion h+, atau lebih tepat, h ion3Sama ada+.
Kemudian, kerana jumlah hidrogen yang dikeluarkan oleh asid lemah dalam larutan akueus adalah rendah, pH yang mereka hasilkan lebih tinggi (asas) daripada yang dihasilkan oleh asid kuat. Contohnya, cuka mempunyai pH 2.5, jus oren pH 3.3. 4.2 dan 2 jus lemon 2.
PH ini, walaupun mereka berasid, lebih tinggi daripada pH yang menghasilkan larutan asid yang kuat (HCl, H, H2SW4, dan lain-lain.) bahawa mereka dapat mencapai nilai 1 atau kurang (nilai pH negatif).
Ciri -ciri asid lemah
pH penyelesaian anda
Asid lemah biasanya mempunyai pH antara 2.0 dan kurang dari 7.0, jadi mereka menghidupkan warna kertas pannasol dengan warna merah. Nilai pH ini lebih tinggi daripada nilai pH yang dihasilkan oleh asid kuat, walaupun terdapat pengecualian.
Sebagai contoh, larutan asid hidroklorik 1 mM (asid kuat), mempunyai pH 3.0, manakala larutan 1 mM asid fluorhoric (asid "lemah"), mempunyai pH 3.2, yang hampir dengan asid kuat.
Pengionan separa
Asid lemah dalam larutan sedikit atau sebahagiannya di dalam air, memisahkan pada asas asid dan hidrogen yang konjugasi. Kemudian, asid lemah dalam larutan berair kebanyakannya dipisahkan, dengan bahagian yang dipisahkan kecil.
Boleh melayani anda: mengimbangi persamaan kimiaApabila jumlah hidrogen yang dikeluarkan oleh asid lemah dalam air adalah rendah, pH yang dihasilkan oleh asid ini lebih tinggi daripada yang dihasilkan oleh asid kuat yang dibubarkan di dalam air, kerana ini biasanya diionkan sebanyak 100 %.
Pengionan yang boleh diterbalikkan
Pengionan asid yang lemah biasanya diserap seperti berikut:
Mempunyai ⇌ a- + H3Sama ada-
Di mana terdapat asid lemah, ke- pangkalannya yang konjugasi, dan h3Sama ada+ kation hidronium, yang merupakan jalan dalam h+ Ia wujud atau ditunjukkan di dalam air. Kepekatan (atau aktiviti) h3Sama ada+ Ia digunakan dan bukannya h+ Untuk penentuan penyelesaian penyelesaiannya.
Ijazah ionisasi
Sebilangan asid lebih lemah daripada yang lain, yang sama untuk dikatakan, mereka kurang terionisasi. Oleh itu, tahap pengionan membolehkan kita melihat bagaimana asid asid dalam keadaan tertentu.
Untuk menyatakan tahap pengionan, beberapa parameter diperkenalkan, seperti pengionan atau pemalar keasidan (ka) dan PKA: cara mengekspresikan KA dalam bilangan mudah yang menghilangkan penggunaan nombor yang dinyatakan dalam kuasa negatif sepuluh (10 ), seperti yang ada di ka.
Pemalar KA dan PKA terutamanya digunakan untuk asid lemah.
Ka = [a-] [H+] / [Ha]
Tanda kurung yang terdapat dalam formula mewakili kepekatan.
pka = - log ka
Nilai PKA asid lemah biasanya berkisar antara 2 dan 12. Tetapi ada pengecualian. Contohnya: dan dan asid odagical (hio3) mempunyai pka 0.77, yang dianggap nilai yang agak kecil, tetapi tanpa negatif, untuk asid lemah dalam erti kata yang ketat.
Kestabilan asas konjugasi
Asid lemah mempunyai ikatan yang kuat dengan atom hidrogen asid (hδ+-Xδ-), jadi mereka mempunyai tahap pemisahan hidrogen yang rendah. Ini mengakibatkan asas asid lemah yang konjugasi mempunyai kekerapan yang besar oleh hidrogen, yang menjadi asas konjugasi yang kuat.
Boleh melayani anda: koloidIaitu, asas konjugasi asid lemah sangat tidak stabil, kerana ia menerima h+ kembali dengan mudah. Semakin tidak stabil asas konjugasi ini, semakin lemah asid akan dipersoalkan.
Kekonduksian ionik yang rendah
Menjadi sedikit terionisasi, asid lemah adalah konduktor elektrik yang lemah, tidak seperti asid kuat yang merupakan konduktor elektrik yang baik.
Kehadiran dalam alam
Asid lemah diedarkan secara meluas, contohnya, mereka berada dalam buah sitrus (lemon, limau gedang, oren, dll).
Mereka juga hadir dalam pelbagai proses yang berlaku di semua makhluk hidup. Sebahagian daripada asid lemah biologi ini adalah pyruvic, laktik, sitrik, fumaric, succinical, glutamic, dll., dan juga hemoglobin oksigen melepaskan hidrogeni, jadi ia berkelakuan seperti asid lemah.
Kemudian, dapat disimpulkan bahawa manusia hidup dalam hubungan tetap dengan asid lemah.
Cara mengira pH asid lemah?
PH asid lemah boleh dikira dengan menggunakan pemalar pengasidan (KA), atau menggunakan persamaan Henderson-Haselbalch. Dalam contoh pertama ka akan digunakan.
Dengan pemalar keasidan
Kirakan pH penyelesaian 0.5 m asid benzoik (c6H5COOH), yang mempunyai pemalar pengionan (ka) = 1.8 x 10-5
C6H5COOH ⇌ c6H5COO- + H+ (1)
Jika jumlah asid yang dipisahkan dipanggil x, maka 0.5 M-X akan menjadi kepekatan asid lemah yang tidak dipisahkan dalam keseimbangan, ia.
Persamaan (1) boleh diwakili seperti berikut:
0.5 m-x ⇌ x +x
Asid lemah diionkan dalam perkadaran yang sangat rendah, jadi kepekatan asid benzoik dalam keseimbangan (0.5 m-x), boleh dianggap sebagai 0.5 m, sejak x <<< 0.5. Sustituyendo en la expresión de Ka resolvemos para X:
Ka = [a-] [H+] / [Ha]
1.8 x 10-5 = (X) (x) / 0.5m
X2 = (1.8 x 10-5) (0.5m)
X = 3 x 10-3 M
Oleh itu, [h+] sama dengan 3 x 10-3 M. Kami menyelesaikannya dengan mengira pH:
Ia boleh melayani anda: Kaedah Mohr: Asas, Reaksi, Prosedur, Kegunaanph = - log [h+]
= - log [3 x 10-3]
pH = 2.52
Perhatikan bahawa pH agak berasid, kerana ia terletak di bawah 3 atau 4.
Dengan persamaan Henderson-Haselbalch
Persamaan Henderson-Haselbalch digunakan untuk mengira pH penyelesaian penampan:
pH = pKA + log [asas konjugasi] / [asid]
Contoh:
Natrium hidroksida (NaOH) ditambah kepada larutan asid asetik, menghasilkan kepekatan akhir asid asetik (CH3COOH) 1.11 x 10-2 mol/l dan kepekatan asas konjugasi (pilih3COO-) daripada 0.44 x 10-2 mol/l. Sekiranya PKA Asid Acetic adalah 4.75 Kirakan pH penyelesaian.
pH = 4.75 +log [a-] / [Ha]
pH = 4.75 +log (0.44 x 10-2 / 1.11 x 10-2)
= 4.75+ log 0.396
= 4.348
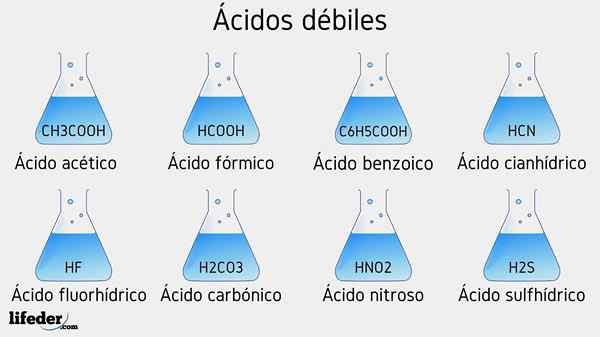
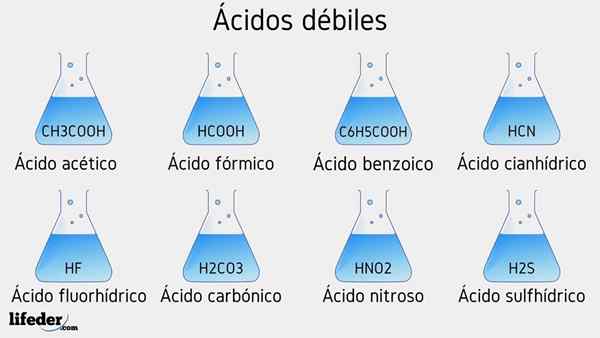
Contoh asid lemah
Beberapa asid lemah yang disertai dengan nilai PKA mereka akan disenaraikan di bawah:
- Ch3COOH (asid asetik), PKA 4.75
- HCOOH (asid formik), PKA 3.74
- C6H5COOH (asid benzoik), PKA 5.59
- Ch2Clcooh (asid kloroasetik), PKA 2.85
- HCN (asid cyanhydric), PKA 9.31
- Hf.17
- C2H5COOH (asid propionik), PKA 4.89
- Hno2 (Asid nitrous), PKA 3.35
- H2S (asid sulfida), PKA1 6.0 dan PKA2 12.92
- CCL3COOH (Asid Trichloroacetic), PKA 0.52
- H2Co3 (asid karbonik), PKA1 6.37 dan PKA2 10.22
- H3PO4 (asid fosforik), PKA1 2.12, PKA2 4.21 dan PKA3 sebelas.0
- C6H5SW3H (asid benzefonik), PKA 0.70
- Hio3 (Asid yodium), PKA 0.77
- Hclo2 (Asid kloro), pKa 2.0
- Ch3Ch2(OH) COOH (asid laktik), PKA 3.08
Asid lemah dengan kegunaan terapeutik
- Asid salisilik, PKA 3.00
- Asid acetylsalicylic, PKA 3.49
- Furosemide, PKA 3.90
- Ibuprofen, PKA 4.40
- Levodopa, pka 2.30
- Phenobarbital, PKA 7.40
- Warfarina, PKA 5.0
- Teofilina, PKA 8.80
Rujukan
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (8th ed.). Pembelajaran Cengage.
- Morris, j. G. (1974). Fizikokimia untuk ahli biologi. (Edisi ke -2.). Saya terbalik.
- Helmestine, Anne Marie, Ph.D. (29 Ogos, 2020). Definisi dan contoh asid lemah dalam kimia. Pulih dari: Thoughtco.com
- Ophardt c., & McCarthy l. (15 Ogos 2020). Kekuatan asid dan asas. Kimia Librettexts. Pulih dari: chem.Libretxts.org
- Clark Jim. (2013). Asid kuat dan lemah. Pulih dari: chemguide.co.UK
- Pembelajaran Lumen. (s.F.). Kimia untuk Bukan Major: Mengira PH Asid Lemah dan Penyelesaian Asas. Pulih dari: kursus.Lumenning.com

