Struktur kalsium karbonat, sifat, pembentukan, kegunaan

- 4285
- 235
- Dallas Bernhard
Dia kalsium karbonat Ia adalah sebatian bukan organik yang formula kimia adalah caco3. Ia didapati terutamanya dalam mineral seperti calcite dan aragonite. Begitu juga, batu kapur itu menyusun, batu sedimen di mana mineral Calcita hadir.
Karbonat logam penting ini diperolehi secara industri oleh pengekstrakan dan pengisaran mineral yang mengandunginya; Hingga akhir ini, marmar digunakan terutamanya. Proses lain terletak pada penggunaan kalsium oksida, yang menjadi kalsium hidroksida, mencetuskan kalsium karbonat dengan penambahan karbon dioksida. Dengan cara ini kristal diperoleh dari pelbagai saiz.
 Cangkang siput terutamanya terdiri daripada kalsium karbonat. Sumber: Pixabay.
Cangkang siput terutamanya terdiri daripada kalsium karbonat. Sumber: Pixabay. Mereka juga boleh digunakan untuk pengeluaran perindustrian Caco3, Dalam skala kecil, cengkerang kerang, cengkerang telur dan cengkerang tiram di mana ia hadir.
Kalsium karbonat yang terdapat di batu kapur dibubarkan oleh karbon dioksida di dalam air, menghasilkan kalsium bikarbonat. Tindakan ini boleh menyebabkan gua -gua dan merupakan punca penghapusan air; peristiwa yang sangat penting dalam penyelenggaraan kehidupan di dalamnya.
Ia telah digunakan dalam pembinaan dan penjelasan patung; Contohnya adalah rakan kongsi Athens, Katedral Krakow, dan arca Abraham Lincoln di Washington. Walau bagaimanapun, kerentanannya terhadap hujan asid telah menurunkan penggunaannya dalam pembinaan.
Kalsium Karbonat mempunyai banyak aplikasi dalam industri sebagai bahan pengisian plastik dan kertas. Dalam bidang perubatan ia telah digunakan untuk mengawal keasidan gastrik; sebagai makanan tambahan kalsium diet; Untuk mengawal fosfatia pada pesakit dengan kegagalan buah pinggang kronik, dll.
[TOC]
Struktur
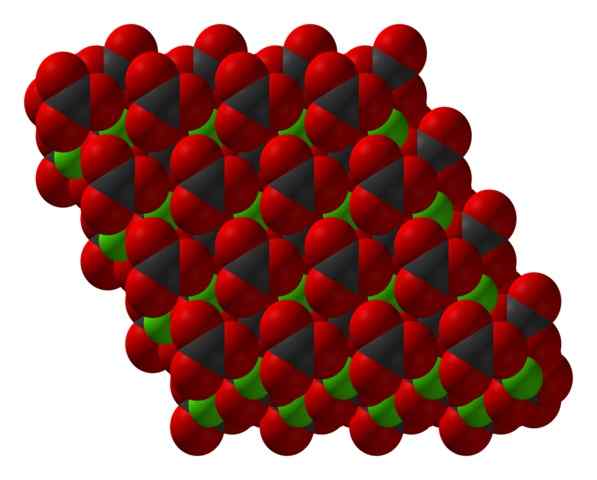 Struktur kristal chanco3 diwakili dengan model pengisian ruang. Sumber: CCOIL [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)]
Struktur kristal chanco3 diwakili dengan model pengisian ruang. Sumber: CCOIL [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)] Formula Kalsium Karbonat, Caco3, menunjukkan bahawa perkadaran antara ion ca2+ dan co32- Ia adalah 1: 1; iaitu, untuk setiap ca2+ Ada co32- rakan sejawat berinteraksi secara elektrostal dengannya. Oleh itu, ikatan ionik akhirnya mempunyai ion -ion ini untuk membentuk corak struktur yang menentukan kristal.
Dalam imej unggul struktur caco ditunjukkan3. Sfera hijau sesuai dengan kation ca2+, dan sfera merah dan hitam ke anion co32-. Perhatikan bahawa struktur nampaknya dibentuk oleh pelbagai lapisan: satu kalsium, dan satu lagi karbonat; yang bermaksud bahawa mengkristal dalam struktur heksagon padat.
Ia boleh melayani anda: Ammonium Chloride (NH4CL)Fasa heksagon ini (β-caco3) Sepadan dengan polimorf. Terdapat dua yang lain: ortorrombic (λ-caco3) dan heksagon yang paling padat (μ-caco3). Imej yang lebih rendah membantu untuk memvisualisasikan Hexagon yang lebih baik:
 Struktur kalsit heksagon. Bahan-bahan di Bahasa Inggeris Wikipedia [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)]
Struktur kalsit heksagon. Bahan-bahan di Bahasa Inggeris Wikipedia [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)] Walau bagaimanapun, bergantung kepada suhu (dan untuk garam ini tekanan) ion dalam getaran mereka disesuaikan dengan struktur lain; Ini adalah polimorf yang disebutkan di atas (β, λ dan μ).
Kerana bunyi mereka tidak diketahui, kecuali jika mereka disebut dengan nama mineralogi mereka di bahagian seterusnya.
Kekerasan protein
Kristal Caco3 Mereka tidak bersendirian: mereka boleh menjadi tuan rumah kekotoran seperti kation logam lain yang pewarna mereka dalam warna; o protein, menggabungkan matriks organik yang entah bagaimana menyumbang kepada kekerasan semula jadi.
Protein mengurangkan ketegangan yang dialami oleh kristal antara satu sama lain sebelum tekanan atau kesan. Sebagai? Apabila meluaskan antara kristal, bertindak seolah-olah ia adalah "pad" (serupa dengan bata simen-sentuhan).
Itulah sebabnya sebatian atau mineral ini bersesuaian, dan tidak terkejut bahawa ia adalah sebahagian daripada kuku, cengkerang laut, kerang atau tulang landak. Ia menjadi sumber inspirasi bagi mereka yang berdedikasi untuk membangunkan bahan baru.
Sifat
Nama lain
-Aragonit
-Calcito
-Volterite
-Susu kalsium
-Papan putih
-Marmar
Jisim molar
100,086 g/mol.
Penerangan fizikal
Tandas debu putih.
Rasa
Sama dengan kapur, tidak sedap.
Titik gabungan dan mendidih
Ia rosak kerana ia melepaskan co2 Sebelum mencair atau mendidih.
Kelarutan
Praktikal tidak larut dalam air dan alkohol. Ia dibubarkan dengan effervescence dalam asid asetik dan hidroklorik yang dicairkan. Hidroksida bagaimanapun, mereka mengurangkan kelarutan mereka. Sementara itu, garam ammonium dan karbon dioksida meningkatkan kelarutan kalsium karbonat di dalam air.
Ketumpatan
2.7 hingga 2.95 g/cm3.
Penguraian
Sekitar 825 ºC dipecah menjadi kalsium oksida (kapur) dan karbon dioksida (CO2).
Ph
8 hingga 9
Indeks refraktif
-1,7216 hingga 300 nm dan 1,6584 hingga 589 nm (Calcita).
-1,5145 hingga 300 nm dan 1,4864 hingga 589 nm (Aragonite).
Ketidakserasian
Dengan asid, garam aluminium dan ammonium.
Entalpi fusion
36 kJ/mol pada 800 ºC (calcite).
Boleh melayani anda: molariti: kepekatan, unit, pengiraan, latihanPemalar produk kelarutan
3.36 · 10-9 pada 25 ºC.
Kekerasan
-3.0 (calcite)
-3.5 - 4.0 (aragonit) pada skala Mohs.
Peralihan fasa
Aragonite metastable dan tidak dapat dipulihkan ke kalsit apabila ia memanaskannya ke udara kering hingga 400 ºC.
Reaktiviti
Kalsium karbonat bertindak balas dengan asid, melepaskan karbon dioksida, kalsium ionik dan air.
Kalsium karbonat digabungkan dengan air tepu dengan karbon dioksida, bersamaan dengan asid karbonik (h2Co3), Untuk membentuk kalsium bikarbonat.
Latihan
Kapur, marmar dan batu kapur, dua mineral pertama dan bahan berbatu yang ketiga, mengandungi kalsium karbonat dan berasal dari sedimen, mereka dianggap dibentuk oleh pemendapan siput selama berjuta -juta tahun.
PH boleh menjadi faktor yang paling penting dalam pembentukan polimorf pada suhu 24 ° C. Vaterita adalah produk utama dalam pelbagai pH antara 8.5 dan 10; Aragonit adalah pH 11; dan kalsit ke ph> 12.
Ia juga diketahui bahawa banyak alga air tawar membina kristal kalsit ketika mereka tumbuh dalam persekitaran tepu kalsium. Di samping itu, microalgae mampu menyebabkan pemendakan kalsium karbonat.
Bentuk kalsium karbonat
Dalam imej di bawah, tiga bentuk utama atau polimorf akan ditunjukkan untuk kalsium karbonat:
 Calcita Crystal. Sumber: Ibu bapa Géry [Domain Awam]
Calcita Crystal. Sumber: Ibu bapa Géry [Domain Awam] Aragonite Crystal. Sumber: Battistini Riccardo [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)]
Aragonite Crystal. Sumber: Battistini Riccardo [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)] Kristal Vaterita. Sumber: Rob Lavinsky, Irocks.COM-CC-BY-SA-3.0 [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)]
Kristal Vaterita. Sumber: Rob Lavinsky, Irocks.COM-CC-BY-SA-3.0 [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)]
Dari atas ke bawah adalah calcite, aragonite dan vaterita polymorphs. Perhatikan perbezaan antara morfologi kristal mereka (warna adalah tipikal asal -usul dan ciri -ciri persekitarannya).
Vaterita lebih legap daripada kalsit, yang terakhir menjadi lengkap. Sementara itu, kristal aragonit menyerupai monolit kecil yang panjang.
Jika sampel ketiga -tiga polimorf ini diperhatikan di bawah mikroskop elektronik, kristal mereka (nada kelabu kerana teknik tidak membenarkan resolusi warna), morfologi yang sama akan ditemui seperti dalam skala makroskopik; iaitu, pada pandangan pertama.
Di antara ketiga -tiga polimorf ini, kalsit adalah yang paling banyak dan stabil, diikuti oleh aragonit, dan akhirnya vaterita, yang paling jarang bentuk Caco3
Boleh melayani anda: kalorimetri: apa kajian dan aplikasiAplikasi
Industrialis
Kalsium karbonat meningkatkan ketahanan terhadap kilasan dan daya tarikan getah sintetik dan asli, mengekalkan kelenturannya. Ia digunakan dalam industri pembinaan sebagai bahan simen dan sebagai bahan mentah untuk kapur. Penggunaannya telah berkurang kerana ia rosak oleh hujan asid.
Kalsium karbonat digunakan dalam penyucian besi. Dalam bentuk kapur menghilangkan sulfur dioksida yang terdapat dalam logam. Penyucian gula bit digunakan. Ia digunakan sebagai kapur untuk slate, tetapi telah digantikan oleh plaster untuk aplikasi ini.
Kalsium karbonat dicampur dengan dempul yang digunakan dalam penempatan kaca. Tanah digunakan sebagai bahan pengisian dalam filem microporous yang digunakan di lampin. Ia juga digunakan sebagai bahan pengisian dalam plastik seperti PVC. Di samping itu, kekuatan plastik meningkat.
Kalsium karbonat digunakan untuk meningkatkan kapasiti liputan lukisan. Ia digunakan sebagai bahan pengisian kertas kerana ia lebih murah daripada serat kayu, dapat mewakili lebih dari 10% dari kertas.
Doktor
Ia digunakan sebagai antacid untuk memerangi hiperaskidal gastrik dan melegakan pencernaan. Ia digunakan sebagai suplemen kalsium makanan dan dalam rawatan dan pencegahan osteoporosis. Ia digunakan dalam rawatan hyperphosphatia pada pesakit yang mengalami kegagalan buah pinggang kronik.
Ia telah digunakan untuk mengurangkan kesan yang tidak diingini dari inhibitor protease yang digunakan dalam rawatan HIV, memerhatikan pada pesakit pengurangan cirit -birit.
Ia menghasilkan penurunan tekanan darah pada wanita hamil dengan hipertensi dan preeklampsia, kerana kedua -duanya boleh dikaitkan dengan peningkatan permintaan kalsium akibat kehadiran janin.
Yang lain
Kalsium karbonat digunakan dalam pertanian sebagai baja dan untuk memerangi keasidan tanah. Ia digunakan sebagai pengawet, penahan warna, dan mengesahkan makanan.
Di samping itu, ia adalah ramuan ubat gigi, dan berfungsi sebagai kasar dalam habuk dalam pembersihan dan mencuci.
Rujukan
- Shiver & Atkins. (2008). Kimia bukan organik. (Edisi Keempat). MC Graw Hill.
- Wikipedia. (2019). Kalsium Karbonat. Diperoleh dari: dalam.Wikipedia.org
- Pusat Kebangsaan Maklumat Bioteknologi. (2019). Kalsium Karbonat. Pangkalan data PUBCHEM., CID = 10112. Pulih dari: pubchem.NCBI.NLM.NIH.Gov
- Kai-Yin Chong, Chin-Hua Chia, dan Sarani Zakaria. (2014). Polimorf kalsium karbonat pada tindak balas suhu. Prosiding Persidangan AIP 1614, 52; doi.org/10.1063/1.4895169
- Greg Watry. (1 November 2016). Menemui Kristal Karbonat Howum Dapatkan Kekuatan. Pemasaran Perniagaan Kelebihan. Pulih dari: rdmag.com
- Elemen Amerika. (2019). Kalsium Karbonat. Diperolehi daripada: Americanements.com
- Elsevier. (2019). Kalsium Karbonat. Scientedirect. Diperoleh dari: Scientedirect.com
- Buku Kimia. (2017). Kalsium Karbonat. Pulih dari: buku kimia.com

