Struktur, LI2CO3) Struktur, Hartanah, Kegunaan Lithium Carbonate

- 2838
- 25
- Julius Dibbert
Dia Lithium karbonat Ia adalah pepejal bukan organik yang dibentuk oleh dua litium li+ dan co anion karbonat32-. Formula kimianya adalah li2Co3. Li2Co3 Ia adalah pepejal kristal putih yang boleh diperolehi oleh tindak balas antara litium hidroksida dan karbon dioksida.
Lithium Carbonate mempunyai titik gabungan yang sangat tinggi, jadi ia digunakan dalam penyediaan kaca, seramik dan porselin. Ia mempunyai kegunaan yang sangat berbeza, seperti bateri litium yang boleh dicas semula, dalam penyediaan sebatian litium lain, elektrod kimpalan dan lukisan dan varnis.
 Lithium carbonate li2Co3 pepejal. Gambar yang diambil oleh W: Pengguna: Walkerma pada bulan Jun 2005. Sumber: Wikimedia Commons.
Lithium carbonate li2Co3 pepejal. Gambar yang diambil oleh W: Pengguna: Walkerma pada bulan Jun 2005. Sumber: Wikimedia Commons. Li juga digunakan2Co3 Dalam campuran simen untuk mencapai tetapan pantas dan pengeluaran aluminium.
Salah satu kegunaannya yang paling penting ialah merawat beberapa penyakit mental seperti kemurungan dan tingkah laku yang berlebihan agresif, antara keadaan lain.
Walau bagaimanapun, penggunaannya sebagai ubat mesti dikawal dengan sewajarnya oleh pakar perubatan kerana orang yang dirawat dengan Li2Co3 Mereka boleh mengalami kesan berbahaya untuk kesihatan, seperti hipotiroidisme (fungsi dikurangkan kelenjar tiroid).
[TOC]
Struktur
Lithium Carbonate terdiri daripada dua litium li+ dan co anion karbonat32-.
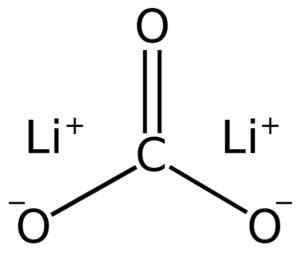 Struktur Karbonat LII Lithium2Co3. Adrian Hands [domain awam]. Sumber: Wikimedia Commons.
Struktur Karbonat LII Lithium2Co3. Adrian Hands [domain awam]. Sumber: Wikimedia Commons. Konfigurasi litium elektronik dalam keadaan pengoksidaan +1 adalah 1s2 2s0, Nah, dia telah kehilangan elektron lapisan terakhir, sehingga menjadi lebih stabil. Co karbonat ion32- Ia mempunyai struktur rata.
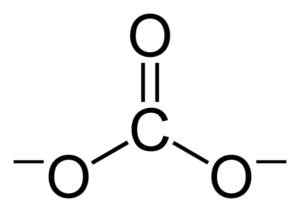 Struktur rata Co Coal Co32-. Benjah-bmm27 [domain awam]. Sumber: Wikimedia Commons.
Struktur rata Co Coal Co32-. Benjah-bmm27 [domain awam]. Sumber: Wikimedia Commons. Beban negatif diedarkan sama rata di antara tiga atom oksigen Co Coal Co32-.
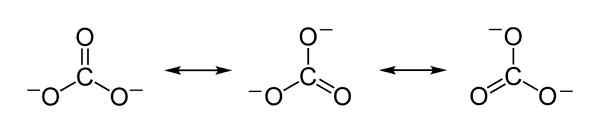 Struktur resonans teoretikal Co Carbonate Ion Co32- yang berfungsi untuk menjelaskan pengagihan beban negatif yang saksama antara 3 atom oksigen. Benjah-bmm27 [domain awam]. Sumber: Wikimedia Commons.
Struktur resonans teoretikal Co Carbonate Ion Co32- yang berfungsi untuk menjelaskan pengagihan beban negatif yang saksama antara 3 atom oksigen. Benjah-bmm27 [domain awam]. Sumber: Wikimedia Commons. Nomenclature
-Lithium karbonat
-Dilitio Carbonate
Ciri-ciri fizikal
Keadaan fizikal
Pepejal putih kristal struktur monoklinik
Berat molekul
73.9 g/mol
Takat lebur
723 ºC
Penguraian
Ia terurai pada 1300 ºC.
Ketumpatan
2.11 g/cm3
Kelarutan
Sedikit larut dalam air: 1.31 % berat pada 20 ºC. Kelarutan airnya berkurangan apabila suhu meningkat. Ia larut dalam asid yang dicairkan. Tidak larut dalam alkohol dan aseton.
Boleh melayani anda: barium oksida (bao): struktur, sifat, kegunaan, risikoPh
Penyelesaian air adalah alkali, mereka mempunyai pH lebih besar daripada 7.
Sifat kimia
Li2Co3 Ia dihidrolisiskan dalam larutan berair yang menghasilkan penyelesaian asas. Bahagian kecil sebatian yang diselesaikan di dalam air meninggalkan anion karbonat co -bebas32-.
Co anion karbonat32- Percuma dalam larutan akueus mengambil proton untuk membentuk anion bikarbonat HCO3-, Seperti yang dapat dilihat dalam reaksi berikut:
Co32- + H2O → HCO3- + Oh-
Kehadiran ion OH- Itulah yang menjadikan penyelesaiannya asas.
Sifat biologi
Di dalam tisu haiwan dan manusia, biasanya terdapat jejak litium, tetapi sehingga saat ini tidak ada peranan fisiologi semulajadi ion ini diketahui.
Dalam organisma manusia li2Co3 Dinestikan sebagai ubat, bertindak pada pelbagai mekanisme isyarat dalam neuron dan sel lain. Ini disebabkan oleh penggantian kation seperti natrium dan kalium.
Penggabungan ion lithium ke dalam struktur membran sel dapat mengubah tindak balas terhadap hormon dan gandingan sel dengan proses tenaga.
Dengan cara ini litium mengubah beberapa proses selular termasuk metabolisme.
Melalui pengubahsuaian jalan di mana sel berfungsi2Co3 Anda boleh bertindak atas mekanisme komunikasi neuron di otak.
Memperoleh
Li2Co3 Ia boleh diperolehi oleh tindak balas litium hidroksida dengan cooksida karbon dioksida2, Seperti yang ditunjukkan di bawah:
2 lioh + co2 → Li2Co3 + H2Sama ada
Secara komersil berlaku dari mineral yang mengandungi litium seperti spodumen dan lepidolit. Galian ini dirawat pada suhu tinggi dengan garam sulfat tertentu atau dengan sebatian alkali untuk mendapatkan garam litium.
Garam litium yang diperolehi disucikan dengan penyelesaian air atau asid dan kemudiannya dirawat dengan karbonat untuk membentuk li2Co3.
Walau bagaimanapun, li2Co3 Dicapai dengan cara ini tercemar dengan sulfat atau kalsium klorida, magnesium, besi, natrium, kalium, dll. Oleh itu, memerlukan penyucian berikutnya.
Aplikasi
Dalam rawatan penyakit mental
Ia digunakan sebagai ejen antidepresan, antimaniac, dalam rawatan tingkah laku agresif-empulsif dan untuk gangguan bipolar (orang yang mengubah humor mereka tiba-tiba tanpa sebarang sebab, menjadi ganas).
Boleh melayani anda: 20 contoh penyejatan dan ciri kimia Beberapa gangguan agresif-empulsif boleh dirawat dengan li2Co3. Pengarang: Prawny. Sumber: Pixabay.
Beberapa gangguan agresif-empulsif boleh dirawat dengan li2Co3. Pengarang: Prawny. Sumber: Pixabay. Doktor telah mengamati bahawa pentadbiran mereka membawa kepada penurunan intensiti dan kekerapan tempoh yang teruk kemurungan dan episod manik.
Ia digunakan semata -mata, iaitu, tanpa sebatian tambahan, dalam terapi penyelenggaraan kemurungan unipolar dan untuk gangguan skizoektif. Ia juga berfungsi untuk meningkatkan kesan antidepresan ubat lain.
Walaupun ia telah digunakan untuk merawat kanak -kanak dengan gejala gangguan bipolar yang jelas dan hiperaktif dengan komponen neurotik atau agresif, ia tidak berkesan dalam semua kes.
Dalam rawatan gejala penyakit lain
Ia digunakan untuk mengurangkan kekerapan sakit kepala yang kuat, berulang dan kronik.
Ia digunakan untuk mengurangkan kejadian jangkitan pada pesakit dengan neutropenia yang disebabkan oleh kemoterapi atau sebab lain. Neutropenia adalah penurunan neutrofil, sejenis sel darah putih yang membantu melawan jangkitan di dalam badan.
Ia telah digunakan sebagai perencat enzim tiroid untuk rawatan hipertiroidisme, tetapi ia tidak disukai rawatan kerana kesan buruknya.
Bentuk pentadbiran
Ia digunakan dalam bentuk tablet atau kapsul Li2Co3. Juga dalam tablet lambat -lambat dengan litium sitrat. Li lebih disukai2Co3 Kerana ia tidak mengganggu tekak ketika menelannya, seperti yang berlaku dengan garam lithium lain.
 Pengarang: Pete Lyforth. Sumber: Pixabay.
Pengarang: Pete Lyforth. Sumber: Pixabay. Kesan buruk
Li2Co3 Ia boleh memberi kesan berbahaya kepada tiroid dan buah pinggang, jadi fungsi organ -organ ini mesti dipantau sebelum dan semasa rawatan dengan kompaun ini.
Li2Co3 Ia boleh menjadi toksik pada kepekatan yang sangat dekat dengan yang digunakan dalam rawatan perubatan, jadi semakan berterusan nilai serum darah mereka diperlukan.
Gejala keracunan li2Co3 Mereka adalah gegaran, kekejangan otot, kelemahan otot, cirit -birit, muntah, mengantuk atau ataxia (kemerosotan dalam koordinasi otot), antara lain.
Pada permulaan lirapy2Co3 Gejala seperti gegaran, sakit kepala dan loya juga boleh berlaku. Tetapi ini cenderung hilang dengan ubat berterusan.
Boleh melayani anda: HolmioKebanyakan orang yang dirawat juga boleh mengembangkan leukositosis (peningkatan bilangan sel darah putih), tetapi ini boleh diterbalikkan.
Orang yang sedang berubat dengan li2Co3 Mereka tidak boleh mengendalikan kenderaan atau mengendalikan jentera, kerana ia mengurangkan koordinasi fizikal dan keupayaan untuk menjalankan aktiviti yang perlu berjaga -jaga.
Kes di mana ia tidak boleh diberikan
Ia tidak boleh digunakan pada kanak -kanak di bawah 12 tahun, kerana ia dapat mengganggu pembentukan tulang dan ketumpatannya, kerana ia mengubah kepekatan hormon tiroid. Ia juga cenderung untuk menduduki tempat kalsium di tulang.
Mereka tidak boleh dilayan dengan li2Co3 Orang yang mempunyai penyakit kardiovaskular, buah pinggang atau tiroid. Tidak juga pesakit yang mengalami dehidrasi.
Wanita hamil tidak boleh ditadbir terutamanya semasa trimester pertama kehamilan. Lithium melintasi plasenta dan dapat mencapai janin dengan mudah dengan kemungkinan kesan teratogenik, iaitu, ia dapat menghasilkan anomali atau kecacatan pada bayi yang sedang membakar.
Orang tua yang memerlukan rawatan dengan Li2Co3 Mereka harus dirawat dengan penuh perhatian dan dengan dos yang lebih rendah daripada orang dewasa muda, kerana mereka dapat mengembangkan penyakit hipotiroidisme.
Kegunaan lain
Li2Co3 Kesucian tinggi digunakan secara meluas dalam pembuatan bateri boleh dicas semula lithium.
Ia digunakan dalam sel bahan bakar karbonat cair.
Ia digunakan dalam pembuatan porselin elektrik yang merupakan jenis porselin penebat elektrik. Ia juga digunakan dalam pengeluaran kaca pada seramik.
 Li2Co3 Ia digunakan untuk membuat porselin elektrik, yang digunakan sebagai penebat elektrik, contohnya dalam jawatan kuasa elektrik. Fir0002 flagstoffotos [at] gmail.com Canon 20D + Tamron 28-75mm f/2.8 [GFDL 1.2 (http: // www.gnu.Org/lesen/lesen lama/fdl-1.2.html)]. Sumber: Wikimedia Commons.
Li2Co3 Ia digunakan untuk membuat porselin elektrik, yang digunakan sebagai penebat elektrik, contohnya dalam jawatan kuasa elektrik. Fir0002 flagstoffotos [at] gmail.com Canon 20D + Tamron 28-75mm f/2.8 [GFDL 1.2 (http: // www.gnu.Org/lesen/lesen lama/fdl-1.2.html)]. Sumber: Wikimedia Commons. Ia membolehkan untuk menyediakan seramik dengan pekali pengembangan yang rendah, iaitu, ia berkembang sangat sedikit apabila meningkatkan suhu, jadi seramik boleh digunakan dalam selang suhu yang lebih tinggi.
Lain -lain kegunaannya adalah sebagai pemangkin, dalam pembuatan sebatian litium lain, seperti elektrod kimpalan, dalam formula cat luminescent, varnis dan pewarna, serta dalam pengeluaran elektrolisis aluminium.
Ia berguna untuk menghasilkan tetapan simen yang lebih cepat dan menambah gam jubin supaya mereka dapat diperbaiki dalam masa yang singkat.
 Pengarang: Capri23Auto. Sumber: Pixabay.
Pengarang: Capri23Auto. Sumber: Pixabay. Rujukan
- Cai, w. et al. (2018). Penyingkiran SO42- dari li2Co3 dengan recrystallization dalam na2Co3. Crystals 2018, 8, 19. MDPI pulih.com.
- Gadikota, g. (2017). Menyambungkan perubahan struktur morfologi dan kristal semasa penukaran monohidrat litium hidroksida ke lithium karbonat menggunakan pengukuran penyebaran sinar-X pelbagai skala. Mineral 2017, 7, 169. MDPI pulih.com.
- Atau.S. Perpustakaan Perubatan Negara. (2019). Lithium karbonat. Pulih dari: pubchem.NCBI.NLM.NIH.Gov.
- Kirk-Othmer (1994). Ensiklopedia Teknologi Kimia. Edisi keempat. John Wiley & Sons.
- Ensiklopedia Kimia Perindustrian Ullmann. (1990). Edisi Kelima. VCH Verlagsgellschaft MBH.
- Kapas, f. Albert dan Wilkinson, Geoffrey. (1980). Kimia bukan organik maju. Edisi keempat. John Wiley & Sons.
- « Contoh, Latihan Sudut Konjugasi Dalaman dan Luaran
- .Struktur, CH3 (CH2) 16COOH) struktur, sifat, kegunaan »

