Ciri dan kesan carboxyhemoglobin
- 2802
- 272
- Horace Gulgowski
The carboxyhemoglobin Ia adalah hemoglobin yang dilampirkan pada karbon monoksida (CO). Hemoglobin adalah protein yang mengangkut oksigen melalui darah ke manusia dan di banyak vertebrata lain.
Untuk mengangkut oksigen, hemoglobin mesti menyertai ini. Max Perutz, seorang ahli kimia dan Hadiah Nobel yang dilahirkan di Vienna pada tahun 1914 dan dibunuh di Cam-Bridge pada tahun 2002, yang dipanggil "Hemoglobin Oxygen Ligning Behavior".
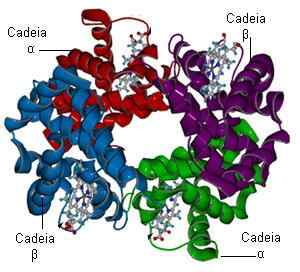
 Struktur Hemoglobin (Sumber: Bielabio melalui Wikimedia Commons)
Struktur Hemoglobin (Sumber: Bielabio melalui Wikimedia Commons) Bayangkan dua molekul hemoglobin yang mampu menyertai setiap molekul oksigen. Seseorang sudah mempunyai tiga molekul oksigen dan yang lain. Sekiranya molekul oksigen lain muncul persoalannya adalah seperti berikut: adakah ia mengikat kepada "kaya" yang sudah mempunyai tiga, atau "miskin" yang tidak mempunyai? Kebarangkalian adalah 100 hingga 1 bahawa molekul yang kaya diarahkan.
Bayangkan sekarang dua molekul hemoglobin lain. Satu mempunyai 4 molekul oksigen (ia tepu) dan yang lain hanya mempunyai satu. Molekul mana yang paling mungkin memberikan oksigen kepada tisu, orang kaya atau golongan miskin? Yang termiskin akan lebih mudah menyampaikan oksigen daripada kaya.
Pengagihan oksigen dalam molekul hemoglobin dapat dilihat sebagai perumpamaan alkitabiah: "... siapa yang akan diberikan dan siapa yang tidak ada, bahkan apa yang dia ada akan dikeluarkan ..." (MT, 13:12 ). Dari sudut pandang fisiologi, tingkah laku "tidak bermoral" molekul hemoglobin ini penuh dengan makna, kedudukan menyumbang kepada sumbangan oksigen ke tisu.
Karbon monoksida, bagaimanapun, apa jua bilangan atom oksigen bersatu dengan molekul hemoglobin, "sapu" dengan semua orang. Iaitu, dengan kehadiran Co yang banyak, semua oksigen yang dilampirkan pada hemoglobin digantikan oleh Co.
[TOC]
Ciri -ciri struktur
Untuk bercakap mengenai carboxyhemoglobin, yang tidak lebih daripada keadaan hemoglobin yang dikaitkan dengan karbon monoksida, perlu terlebih dahulu merujuk kepada hemoglobin secara umum.
Hemoglobin adalah protein yang terdiri daripada empat subunit yang dibentuk masing -masing oleh rantai polipeptida yang dikenali sebagai globin dan kumpulan alam bukan protein (kumpulan prostetik) yang dipanggil hemo.
Boleh melayani anda: bioestadistik: sejarah, bidang pengajian dan aplikasiSetiap kumpulan hemo mengandungi atom besi dalam keadaan ferus (iman2+). Ini adalah atom yang mampu menyertai oksigen tanpa pengoksidaan.
Tetramer hemoglobin dibentuk oleh dua subunit alpha globin, 141 asid amino masing -masing, dan dua subunit beta globin, 146 asid amino masing -masing.
Bentuk atau struktur hemoglobin
Apabila hemoglobin tidak dikaitkan dengan mana -mana atom oksigen, struktur hemoglobin adalah tegar atau tegang, produk pembentukan jambatan garam di dalamnya.
Struktur kuartal hemoglobin tanpa oksigen (deoxigenada) dikenali sebagai "T" atau struktur tegang, dan hemoglobin oksigen (oxyhemoglobin) dikenali sebagai "R" atau struktur santai.
Peralihan dari struktur t ke struktur r berlaku melalui kesatuan oksigen ke atom besi feros (iman2+) dari kumpulan hemo yang dilampirkan pada setiap rantai globin.
Tingkah laku koperasi
Subunit yang membentuk struktur hemoglobin menunjukkan tingkah laku koperasi yang dapat dijelaskan dengan contoh berikut.
Anda boleh membayangkan molekul hemoglobin deoxygenated (dalam struktur t) sebagai kulit bulu dengan tapak mengikat oksigen yang tersembunyi (kumpulan hem) di dalamnya.
Apabila struktur tegang ini menyertai molekul oksigen, kelajuan kesatuan sangat perlahan, tetapi kesatuan ini mencukupi untuk melonggarkan bola sedikit dan membawa kumpulan hemo berikut ke permukaan, menjadikan kelajuan yang mengikat oksigen berikut lebih besar, mengulangi proses dan meningkatkan pertalian dengan setiap kesatuan.
Kesan karbon monoksida
Untuk mengkaji kesan karbon monoksida pada pengangkutan darah gas, pertama kali perlu.
Boleh melayani anda: briologi: apa, sejarah, kajian apaKeluk oxihemoglobin mempunyai bentuk sigmoid atau "s" yang berbeza -beza bergantung kepada tekanan oksigen separa. Carta lengkung jelas dari analisis yang dibuat kepada sampel darah yang digunakan untuk membinanya.
Kawasan lengkung yang paling cenderung diperoleh dengan tekanan di bawah 60 mmHg dan pada tekanan yang lebih besar daripada ini, lengkung cenderung meratakan, seolah -olah mencapai dataran tinggi.
Apabila di hadapan bahan tertentu, lengkung dapat menunjukkan penyimpangan yang ketara. Penyimpangan ini menunjukkan perubahan yang berlaku dalam pertalian hemoglobin kerana oksigen dengan po yang sama2.
Untuk mengukur fenomena ini, ukuran pertalian hemoglobin oleh oksigen diperkenalkan, yang dikenali sebagai nilai plima puluh, yang merupakan nilai tekanan oksigen separa yang hemoglobin adalah 50% tepu; iaitu, apabila separuh daripada kumpulan hemo mereka bersatu dengan molekul oksigen.
Dalam keadaan standard, yang mesti difahami sebagai pH 7.4, tekanan oksigen 40 mmHg separa dan suhu 37 ° C, p, plima puluh Di bawah lelaki dewasa ialah 27 mm Hg atau 3.6 kPa.
Faktor apa yang boleh menjejaskan pertalian hemoglobin oleh oksigen?
Affinity untuk oksigen hemoglobin yang terkandung dalam erythrocytes dapat berkurangan dengan kehadiran 2.3 defosphoglycerate (2-3dpg), karbon dioksida (CO2), kepekatan proton yang tinggi atau dengan peningkatan suhu; Dan perkara yang sama berlaku untuk karbon monoksida (CO).
Implikasi fungsional
Karbon monoksida dapat mengganggu fungsi pengangkutan oksigen dalam darah arteri. Molekul ini mampu menyertai hemoglobin dan membentuk carboxyhemoglobin. Ini kerana ia mempunyai pertalian untuk hemoglobin kira -kira 250 kali lebih besar daripada o2, Oleh itu, dia dapat memindahkannya walaupun dia dikaitkan dengannya.
Boleh melayani anda: Czapek Agar: Yayasan, Penyediaan, Kegunaan dan BatasanTubuh menghasilkan karbon monoksida secara kekal, walaupun dalam kuantiti yang kecil. Gas ini, tidak berwarna dan tandas, menyertai kumpulan hemo dengan cara yang sama seperti itu atau2, Dan biasanya terdapat kira -kira 1% hemoglobin darah seperti carboxyhemoglobin.
Oleh kerana pembakaran bahan organik yang tidak lengkap menghasilkan CO, perkadaran carboxyhemoglobin dalam perokok jauh lebih tinggi, dapat mencapai nilai antara 5 dan 15% daripada jumlah hemoglobin. Peningkatan kronik dalam kepekatan carboxyhemoglobin memudaratkan kesihatan.
Peningkatan jumlah CO yang menyedut yang menghasilkan lebih daripada 40% carboxyhemoglobin mengancam kehidupan. Apabila tapak mengikat besi ferus diduduki oleh CO, anda tidak boleh memukul o2.
Kesatuan bersama menghasilkan peralihan dari hemoglobin ke struktur r, sehingga hemoglobin terus mengurangkan keupayaan untuk menyampaikan atau2 Dalam kapilari darah.
Carboxyhemoglobin mempunyai warna merah ringan. Oleh itu, pesakit yang diracuni dengan CO mengamalkan warna merah jambu, walaupun dalam keadaan lumpuh koma dan pernafasan. Rawatan terbaik untuk cuba menyelamatkan nyawa pesakit -pesakit ini adalah untuk menjadikan oksigen yang tulen, malah hiperbarik menghirup, untuk cuba menggantikan kesatuan besi dengan co.
Rujukan
- Fox, s. Yo. (2006). Edisi ke -9 Fisiologi Manusia (ms. 501-502). McGraw-Hill Press, New York, Amerika Syarikat.
- Murray, r. K., Granner, d. K., Mayes, ms. Ke., & Rodwell, v. W. (2014). Biokimia Illustrated Harper. McGraw-Hill.
- Rawn, j. D. (1998). Biokimia (1989). Burlington, North Carolina: Neil Patterson Publishers (c) n. Lalioti, CP Raptopoulou, a. Terzis, a. Panagiotopoulos, SP PerlePes, dan. Manessi-Zouopa, j. Chem. SOC. Dalton Trans, 1327.
- Robert m. Berne, Matthew N. Levi. (2001) Fisiologi. (Edisi ke -3.) Edisi harcourt, s.Ke.
- Barat, J. B. (1991). Asas fisiologi amalan perubatan. Williams & Wilkins

