Beban rasmi
- 5039
- 1368
- Julius Dibbert
Apakah beban rasmi?
The Beban rasmi (Cf) adalah salah satu yang diberikan kepada atom molekul atau ion, yang membolehkan untuk menerangkan struktur dan sifat kimianya bergantung pada ini. Konsep ini membayangkan pertimbangan watak maksimum kovalensi dalam pautan A-B; iaitu, sepasang elektron dikongsi bersama antara a dan b.
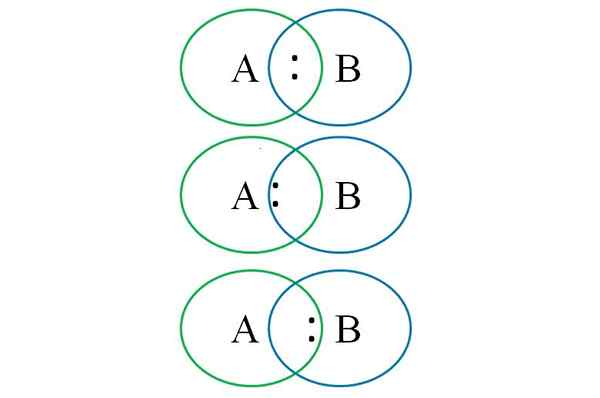
Untuk memahami perkara di atas dalam imej yang lebih rendah, dua atom yang dipautkan ditunjukkan: satu yang ditetapkan dengan huruf A dan yang lain dengan huruf b. Seperti yang dapat dilihat, dalam memintas bulatan, pautan dengan pasangan itu terbentuk ":". Dalam molekul heteronuklear ini, jika a dan b mempunyai elektronegativiti yang sama tork ":" tetap sama dengan kedua -dua a dan b.

Walau bagaimanapun, memandangkan dua atom yang berbeza tidak boleh mempunyai sifat yang sama, pasangan ":" tertarik dengan yang lebih banyak elektronegatif. Dalam kes ini, jika A lebih elektronegatif daripada B, pasangan ":" lebih dekat dengan b. Sebaliknya berlaku apabila B lebih elektronegatif daripada A, kini menghampiri ":" A B.
Kemudian, untuk memberikan caj rasmi kedua -dua A dan B, adalah perlu untuk mempertimbangkan kes pertama (yang di atas imej). Sekiranya pautan kovalen semata-mata pecah, perpisahan homolitik akan berlaku, menghasilkan radikal bebas A · dan · b.
Faedah kualitatif penggunaan beban rasmi
Elektron tidak tetap, seperti dalam contoh sebelumnya, tetapi mereka bergerak dan hilang oleh atom molekul atau ion. Jika ia adalah molekul diatomik, diketahui bahawa pasangan ":" mesti dikongsi atau mengembara antara kedua -dua atom; Perkara yang sama berlaku dalam molekul jenis A-B-C, tetapi dengan kerumitan yang lebih besar.
Walau bagaimanapun, apabila atom dikaji dan menganggap seratus peratus kovalensi dalam pautannya, lebih mudah untuk menentukan sama ada dalam kemenangan kompaun atau kehilangan elektron. Untuk menentukan keuntungan atau kerugian ini, keadaan basal atau bebas anda mesti dibandingkan dengan persekitaran elektronik anda.
Boleh melayani anda: Undang -undang Amagat: Penjelasan, Contoh, LatihanDengan cara ini, adalah mungkin untuk memberikan beban positif (+) jika atom kehilangan elektron, atau beban negatif (-) apabila, sebaliknya, elektron menang (tanda-tanda mesti ditulis di dalam bulatan).
Oleh itu, walaupun elektron tidak dapat ditempatkan tepat, beban rasmi ini (+) dan (-) dalam struktur diselaraskan dalam kebanyakan kes ke sifat kimia yang diharapkan.
Iaitu, beban formal atom berkait rapat dengan geometri molekul persekitaran dan kereaktifannya dalam kompaun.
Formula dan cara mengiranya
Adalah beban rasmi sewenang -wenangnya diberikan? Jawapannya adalah tidak. Untuk ini, keuntungan atau kehilangan elektron mesti dikira dengan mengandaikan ikatan kovalen semata -mata, dan ini dicapai melalui formula berikut:
Cf = (nombor kumpulan atom) - (bilangan pautan bentuk itu) - (bilangan elektron yang dibongkar)
Jika atom mempunyai CF dengan nilai +1, beban positif ( +) diberikan; Walaupun jika anda mempunyai CF dengan nilai -1, ia kemudian diberikan beban negatif ( -).
Untuk mengira CF dengan betul, langkah -langkah mesti diikuti di bawah:
- Cari kumpulan mana yang menjadi atom dalam jadual berkala.
- Kira bilangan pautan yang terbentuk dengan jirannya: pautan berganda (=) bernilai dua dan pautan triple bernilai tiga (≡).
- Akhirnya, mengira bilangan elektron yang tidak dikongsi, yang boleh diperhatikan dengan mudah dengan struktur Lewis.
Variasi pengiraan mengikut struktur
Memandangkan molekul linear A-B-C-D, beban formal untuk setiap atom boleh berubah jika struktur, sebagai contoh, kini ditulis sebagai: B-C-A-D, C-A-B-D, A-C-D-B, dll. Ini kerana terdapat atom yang, dengan berkongsi lebih banyak elektron (membentuk lebih banyak ikatan), memperoleh CF positif atau negatif.
Ia boleh melayani anda: Meniscus (Kimia)Jadi yang mana dari tiga struktur molekul yang mungkin sesuai dengan sebatian ABCD? Jawapannya ialah: yang umumnya mempunyai nilai CF terendah; Juga, yang memberikan beban negatif (-) kepada atom elektronegatif yang paling.
Jika C dan D lebih elektronegatif daripada A dan B, maka dengan berkongsi lebih banyak elektron, mereka memperoleh beban formal yang positif (dilihat dari peraturan mnemonik).
Oleh itu, struktur yang paling stabil, dan tenaga yang paling disukai, adalah c-a-b-d, kerana dalam kedua-dua c dan b mereka hanya membentuk satu pautan. Sebaliknya, struktur a-b-d-d dan mereka yang mempunyai c atau b yang membentuk dua pautan (-c- atau -d-), lebih tidak stabil.
Yang mana semua struktur adalah yang paling tidak stabil? A-c-d-b, kerana bukan hanya c dan d membentuk dua pautan, tetapi juga beban formal negatif mereka (-) bersebelahan antara satu sama lain, selanjutnya menjejaskan struktur.
Contoh pengiraan beban rasmi
Bf4- (Tetrafluoroborato ion)
Atom boron dikelilingi oleh empat atom fluorin. Oleh kerana B milik Kumpulan IIIA (13) tidak mempunyai elektron yang dikongsi bersama dan membentuk empat ikatan kovalen, CFnya (3-4-0 = -1). Sebaliknya untuk F, elemen kumpulan VIIA (17), CFnya ialah (7-6-1 = 0).
Untuk menentukan beban ion atau molekul, sudah cukup untuk menambah CF individu atom yang mengarangnya: (1 (-1) + 4 (0) = -1).
Walau bagaimanapun, CF untuk B tidak mempunyai makna sebenar; Ini, mengenai perkara ini tidak tinggal kepadatan elektronik terbesar. Sebenarnya, ketumpatan elektronik ini diedarkan kepada empat atom F, lebih banyak elemen elektronegatif daripada b.
Boleh melayani anda: asid lemahBeh2 (Beryllium hidrida)
Atom berilium tergolong dalam kumpulan IIA (2), membentuk dua pautan dan kekurangan, sekali lagi, tidak dikongsi elektron. Oleh itu, CF untuk BE dan H adalah:
CfMenjadi= 2-2-0 = 0
CfH= 1-1-0 = 0
Beban beh2= 1 (0) + 2 (0) = 0
CO (karbon monoksida)
Struktur Lewisnya boleh diwakili sebagai: C≡O: (walaupun ia membentangkan struktur resonans lain). Mengulangi pengiraan CF, kali ini untuk C (kumpulan VAT) dan O (kumpulan VIA), anda mempunyai:
CfC= 4-3-2 = -1
CfSama ada= 6-3-2 = +1
Ini adalah contoh di mana caj rasmi tidak sesuai dengan sifat unsur -unsur. ATAU lebih elektronegatif daripada C dan, oleh itu, tidak boleh membawa positif.
Struktur lain (c = o dan (+Co(-)), walaupun mereka mematuhi peruntukan yang koheren beban, mereka gagal mematuhi peraturan oktet (C mempunyai kurang daripada lapan elektron Valencia).
NH4+ (ion ammonium), NH3 dan NH2- (ion amiduro)
Lebih banyak elektron berkongsi N, semakin positif CFnya (kepada ion ammonium, kerana ia tidak mempunyai ketersediaan tenaga untuk membentuk lima bon).
Juga menggunakan pengiraan untuk ammonium N, ammonia dan ion amiduro, maka mempunyai:
Cf = 5-4-0 = +1 (NH4+)
Cf = 5-3-2 = 0 (NH3)
Dan akhirnya:
Cf = 5-2-4 = -1 (NH2-)
Iaitu, di NH2- N mempunyai empat elektron yang tidak dikongsi, dan berkongsi semua apabila ia membentuk NH4+. CF untuk H adalah sama dengan 0 dan, oleh itu, pengiraan anda disimpan.

