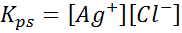Undang -undang Tindakan Massa

- 2599
- 59
- Dallas Bernhard
 Reaksi hujan melibatkan keseimbangan kelarutan, yang ditadbir oleh undang -undang tindakan massa
Reaksi hujan melibatkan keseimbangan kelarutan, yang ditadbir oleh undang -undang tindakan massa Apakah undang -undang tindakan massa?
The Undang -undang Tindakan Massa menyatakan bahawa kelajuan tindak balas bergantung kepada kepekatan reaktannya yang dibangkitkan kepada pekali stoikiometriknya. Undang -undang ini membolehkan satu sama lain kepekatan dalam keseimbangan reaktan dan produk tindak balas kimia yang boleh diterbalikkan. Dengan kata lain, ia menetapkan formula pemalar keseimbangan.
Undang -undang Tindakan Massa diiktiraf oleh ahli kimia Norway (dan krim) Cato m. Guldberg (1836-1902) dan Peter Waage (1833-1900) pada tahun 1864. Ini adalah salah satu undang -undang asas kimia, kerana ia membolehkan kita mengira kepekatan akhir dalam keseimbangan dari jumlah awal.
Di samping itu, undang -undang massa juga membolehkan kita dengan mudah memahami kesan perubahan dalam kepekatan mana -mana spesies pada keseimbangan. Dengan kata lain, ia membolehkan kita memahami bagaimana prinsip Le Chatlier berfungsi.
Walaupun dipanggil "undang -undang tindakan massa", ia tidak benar -benar merujuk kepada jisim reaktan dan produk, tetapi, sebaliknya, kepada kepekatan mereka. Sebab yang dipanggil undang -undang tindakan massa dan bukan undang -undang tindakan kepekatan adalah kerana kepekatan yang digunakan untuk dipanggil "jisim aktif".
Undang -undang tindakan massa dan pemalar keseimbangan
Menurut undang -undang tindakan massa, apabila tindak balas boleh terbalik mencapai keseimbangan itu bukan kerana reaksi berhenti. Sebaliknya, baki dicapai apabila kelajuan tindak balas langsung dilakukan sama dengan kelajuan reaksi songsang. Apabila itu berlaku, semua spesies kimia berlaku dan dimakan pada kelajuan yang sama, jadi kepekatan mereka menjadi malar (mereka berhenti berubah).
Boleh melayani anda: toluena: struktur, sifat, kegunaan, memperolehGuldberg dan Waage mendapati bahawa kelajuan kedua -dua reaksi (langsung dan songsang) bergantung kepada kepekatan molar (dalam mol/l) pada reagen mereka ditinggikan ke pekali stoikiometrik. Dari pemerhatian ini mereka berjaya mencari formula untuk pemalar keseimbangan.
Mengikut undang -undang ini, untuk sebarang tindak balas kimia yang boleh diterbalikkan yang mencapai keseimbangan,
"... Hubungan antara produk kepekatan molar produk yang dibangkitkan kepada pekali stoikiometrik mereka dan produk kepekatan molar reaktan yang dibangkitkan kepada pekali stoikiometrik mereka adalah tetap pada suhu tertentu."
Pemalar ini dipanggil "pemalar keseimbangan" dan diwakili dengan simbol Kc.
Formula malar keseimbangan
Mari lihat bagaimana pernyataan sebelumnya kelihatan dalam bentuk persamaan matematik. Ia adalah tindak balas kimia yang boleh diterbalikkan seperti yang dibentangkan di bawah, di mana A dan B adalah reaktan, C dan D produk, dan A, B, C dan D adalah koefisien stoikiometrik masing -masing reaksi seimbang:
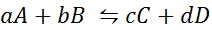
Untuk tindak balas generik seperti ini, pemalar keseimbangan diberikan oleh:
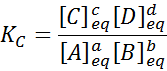
di mana [a], [b], [c] dan [d] adalah kepekatan molar a, b, c dan d seimbang.
Keseimbangan tetap dalam tekanan
Formula sebelumnya untuk pemalar keseimbangan berlaku untuk sebarang tindak balas kimia di mana semua bahan berada dalam fasa yang sama (iaitu, mereka semua berada dalam fasa akueus, atau dalam fasa gas, misalnya). Walau bagaimanapun, dalam hal tindak balas fasa gas, lebih mudah untuk bekerja dengan tekanan daripada dengan kepekatan.
Oleh kerana kepekatan gas molar adalah berkadar dengan tekanan separa mereka, maka formula pemalar keseimbangan dapat ditulis semula dari segi tekanan ini, seperti berikut:
Ia dapat melayani anda: 30 kegunaan asid karboksilik dalam kehidupan seharian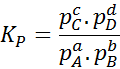
Di mana pKe, pB, pC Dan pD Mereka adalah tekanan separa masing -masing a, b, c dan d, dan a, b, c dan d kekal sebagai pekali stoikiometrik. Dalam kes ini, kP Ia dipanggil keseimbangan berterusan dalam tekanan, dan berkaitan dengan kC Melalui formula berikut:
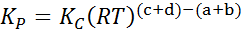
di mana r adalah pemalar sejagat gas ideal dan t adalah suhu mutlak di kelvin.
Reaksi yang melibatkan lebih daripada satu fasa
Kadang -kadang, tindak balas kimia melibatkan pembentukan pepejal sebagai mendakan dari larutan, atau pembentukan cecair dari reaktan yang bertindak balas dalam fasa gas. Dalam kes ini, tindak balas tidak berlaku dalam fasa yang sama, jadi kita mesti mengubah formula pemalar keseimbangan.
Nasib baik, pengubahsuaian sangat mudah. Satu -satunya perkara yang perlu kita ambil kira ketika menulis formula pemalar keseimbangan adalah bahawa bahan -bahan murni yang muncul sebagai pepejal atau cecair tidak boleh membawa mereka ke dalam akaun. Sekiranya perlu, sebaliknya kita meletakkan 1.
Sebagai kesimpulan, undang -undang tindakan massa membolehkan untuk menulis formula pemalar keseimbangan baik dalam kepekatan dan tekanan separa. Setelah mengetahui salah satu daripada kedua -dua, yang lain dapat ditemui dari yang pertama.
Akhir.
Contoh penggunaan undang -undang tindakan massa
Dalam contoh berikut, kami menunjukkan cara menggunakan undang -undang tindakan massa untuk menulis formula pemalar keseimbangan untuk pelbagai jenis tindak balas kimia.
Reaksi reaksi dalam keadaan gas
Contoh 1: Penguraian n2Sama ada4 dalam fasa gas
N2Sama ada4 Ia adalah gas coklat yang rosak mengikut reaksi berikut:
Ia boleh melayani anda: asid láuric: struktur, sifat, kegunaan, faedah, kesan
 Sampel NO2 pada suhu yang berbeza yang menunjukkan anjakan keseimbangan ke N2O4 coklat
Sampel NO2 pada suhu yang berbeza yang menunjukkan anjakan keseimbangan ke N2O4 coklat Untuk tindak balas ini, pemalar keseimbangan dalam kepekatan dan tekanan diberikan oleh:
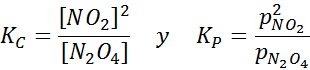
Contoh 2: Pengoksidaan karbon monoksida
Karbon monoksida adalah gas yang sangat toksik yang boleh menjadi karbon dioksida apabila bertindak balas dengan oksigen mengikut reaksi berikut:
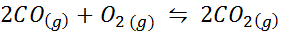
Untuk tindak balas ini, pemalar keseimbangan dalam kepekatan dan tekanan diberikan oleh:
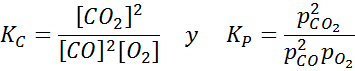
Baki asas asid dalam fasa berair
Contoh 3: Air diri -panjang
Keseimbangan air ionik, yang juga dikenali sebagai tindak balas diri sendiri, adalah tindak balas yang boleh diterbalikkan antara dua molekul air dalam keadaan cecair. Tindak balasnya adalah:
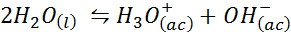
Semasa menulis pemalar keseimbangan untuk tindak balas ini, kita mesti mengambil kira bahawa, dalam kes ini, satu -satunya reagen adalah cecair tulen yang kepekatannya adalah malar. Atas sebab ini, ia tidak termasuk dalam formula pemalar keseimbangan:
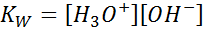
Ini adalah pemalar keseimbangan yang sangat penting yang menerima namanya sendiri (pemalar produk ionik air) dan simbolnya sendiri (kW. W merujuk kepada air dalam bahasa Inggeris, yang dikatakan tandas). Walau bagaimanapun, ia adalah keseimbangan konsentrasi seperti yang lain.
Baki kelarutan
Contoh 4: Keseimbangan Kelarutan Klorida Perak
Apabila kita menyediakan penyelesaian tepu, keseimbangan kelarutan ditubuhkan. Dalam kes ini, keseimbangan adalah pembubaran klorida perak, yang reaksinya diberikan oleh:
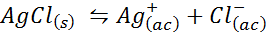
Pemalar keseimbangan tindak balas ini (dan semua tindak balas penyelesaian) tidak termasuk perak klorida (AGCL) kerana ia adalah pepejal. Di samping itu, seperti dalam kes air, pemalar ini juga menerima nama khas yang "tetap produk kelarutan", diwakili sebagai k$: