Asid fluorhoric (HF)
- 1902
- 537
- Kerry Schmitt
Apa itu asid fluorhoric?
Dia asid hidrofluorik (HF)Ia adalah larutan berair di mana fluorida hidrogen dibubarkan. Asid ini terutamanya diperolehi daripada tindak balas asid sulfurik yang tertumpu dengan mineral fluorit (CAF2). Mineral ini direndahkan oleh tindakan asid dan air yang tersisa larut gas fluorida hidrogen.
Dari air berasid yang sama, produk tulen boleh disuling, iaitu, fluorida hidrogen anhidrida. Bergantung pada jumlah gas terlarut, kepekatan yang berbeza diperoleh dan, oleh itu, beberapa produk asid fluorhorhoric yang ada di pasaran.
Pada kepekatan kurang daripada 40 %, ia mempunyai penampilan air kristal yang tidak dapat dibezakan, tetapi pada kepekatan yang lebih tinggi ia mengucapkan selamat tinggal kepada wap fluorida hidrogen putih. Asid fluorhoric dikenali sebagai salah satu bahan kimia yang paling agresif dan berbahaya.
Ia dapat "makan" hampir apa -apa bahan yang anda hubungi: dari kaca, seramik dan logam, ke batu dan konkrit. Di mana bekas kemudian disimpan? Dalam botol plastik, polimer sintetik lengai untuk tindakan anda.
Formula
Formula fluorida hidrogen adalah HF, tetapi asid fluorhoric diwakili dalam medium berair, HF (AC), untuk membezakan dirinya dari yang pertama.
Oleh itu, asid fluorhoric boleh dianggap sebagai hidrat hidrogen fluorida, dan ini adalah anhidrida.
Struktur asid hidrofluorik
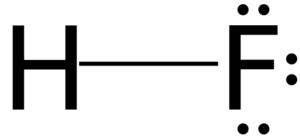 Model 3D asid fluorhydric
Model 3D asid fluorhydric Semua asid dalam air mempunyai keupayaan untuk menjana ion dalam reaksi keseimbangan. Dalam kes asid fluorida, dianggarkan bahawa dalam penyelesaian terdapat sepasang hones h3Sama ada+ dan f-.
Anion f- Mungkin membentuk jambatan hidrogen yang sangat kuat dengan salah satu hidrogen kation (F-H-O+-H2). Ini menjelaskan mengapa asid fluorhorhoric adalah asid bree yang lemah (penderma proton, h+), walaupun kereaktifan yang tinggi dan berbahaya; iaitu, di dalam air tidak melepaskan begitu banyak h+ berbanding dengan asid lain (HCl, HBR atau HI).
Ia boleh melayani anda: Berapa banyak elektron custain yang dimiliki oleh karbon?Walau bagaimanapun, dalam interaksi asid fluorhorhoric pekat antara molekul fluorida hidrogen cukup berkesan untuk membolehkan mereka melarikan diri dalam fasa gas.
Iaitu, di dalam air mereka dapat berinteraksi seolah -olah mereka berada dalam anhidrida cecair, dengan itu membentuk jambatan hidrogen antara ini. Jambatan hidrogen ini dapat diasimilasikan sebagai rantai hampir linear (H-F-H-F-F-F- ...) dikelilingi oleh air.
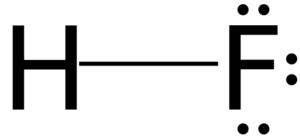
Dalam imej yang unggul, tork tidak dikongsi elektron berorientasikan ke arah yang bertentangan dengan pautan (h-f :) berinteraksi dengan molekul HF yang lain untuk memasang rantai.
Sifat asid hidrofluorik
Kerana ia adalah asid fluorhorhoric larutan berair, sifatnya bergantung kepada kepekatan anhydride yang dibubarkan di dalam air. HF sangat larut dalam air dan hygroscopic, dapat menghasilkan pelbagai penyelesaian: dari sangat pekat (merokok dan nada kuning) hingga sangat cair.
Apabila kepekatannya berkurangan, HF (AC) mengamalkan sifat lebih serupa dengan air tulen daripada anhidrida. Walau bagaimanapun, jambatan hidrogen H-F-H lebih kuat daripada yang ada di dalam air, H2Oh oh.
Kedua -duanya wujud bersama dalam keharmonian dalam penyelesaian, menaikkan titik mendidih (sehingga 105ºC). Begitu juga, ketumpatan meningkat apabila lebih banyak hinhydrid dibubarkan. Selebihnya, semua penyelesaian HF (AC) mempunyai bau yang kuat dan menjengkelkan dan tidak berwarna.
Reaktiviti
Jadi apakah tingkah laku yang menghakis asid fluorhoric? Jawapannya adalah dalam pautan H-F dan keupayaan atom fluorin membentuk pautan kovalen yang sangat stabil.
Sebagai fluorida adalah atom yang sangat kecil dan elektronegatif, ia adalah asid Lewis yang kuat. Iaitu, ia memisahkan dari hidrogen ke menghubungkan spesies yang menawarkan lebih banyak elektron ke kos tenaga yang rendah. Sebagai contoh, spesies ini boleh menjadi logam, seperti silikon yang terdapat di kaca.
Ia boleh melayani anda: Kimia Nuklear: Sejarah, Bidang Pengajian, Kawasan, AplikasiSIO2 + 4 HF → SIF4(g) + 2 jam2Sama ada
SIO2 + 6 HF → H2Sif6 + 2 jam2Sama ada
Sekiranya tenaga pemisahan pautan H-F adalah tinggi (574 kJ/mol), mengapa ia dipecahkan dalam reaksi? Jawapannya mempunyai nuansa kinetik, struktur dan tenaga. Secara umum, kurang reaktif produk yang dihasilkan, semakin disukai pembentukannya adalah.
Apa yang berlaku kepada f- dalam air? Dalam penyelesaian pekat asid fluorhorical lain molekul HF boleh membentuk jambatan hidrogen dengan f- pasangan [h3Sama ada+F-].
Ini mengakibatkan penjanaan ion defluorida [FHF]-, yang sangat berasid. Itulah sebabnya semua hubungan fizikal dengan ini sangat berbahaya. Pendedahan sedikit pun dapat mencetuskan tak terhingga kerosakan pada agensi.
Terdapat banyak standard keselamatan dan protokol untuk pengurusan yang mencukupi, dan dengan itu mengelakkan kemalangan yang berpotensi kepada mereka yang beroperasi dengan asid ini.
Penggunaan/Aplikasi Asid Fluorhorhoric
Ia adalah sebatian dengan banyak aplikasi dalam industri, dalam penyelidikan dan dalam kerja pengguna:
- Asid fluorhoric menghasilkan derivatif organik yang terlibat dalam proses penyucian aluminium.
- Ia digunakan dalam pemisahan isotop uranium, seperti dalam kes uranium hexafluoruro (uf6). Ia juga digunakan dalam pengekstrakan, pemprosesan dan penapisan logam, batu dan minyak, juga digunakan untuk menghalang pertumbuhan acuan dan penyingkiran acuan.
- Ciri -ciri asid yang menghakis telah digunakan untuk mengukir dan merekodkan kristal, terutamanya sejuk, melalui teknik etsa.
- Ia digunakan dalam pembuatan semikonduktor silikon, dengan pelbagai kegunaan dalam pembangunan pengkomputeran dan sains komputer, yang bertanggungjawab untuk pembangunan manusia.
- Ia digunakan dalam industri kereta sebagai pembersih, digunakan sebagai penghilang acuan dalam seramik.
- Di samping berkhidmat sebagai perantara dalam beberapa tindak balas kimia, asid fluorhoric digunakan dalam beberapa penukar ion yang terlibat dalam pemurnian logam dan bahan yang lebih kompleks.
- Mengambil bahagian dalam pemprosesan minyak dan derivatifnya, yang telah membolehkan mendapatkan pelarut untuk digunakan dalam pembuatan produk untuk pembersihan dan penghapusan lemak.
- Ia digunakan dalam penjanaan ejen untuk rawatan venir dan permukaan.
- Pengguna menggunakan pelbagai produk di mana asid fluorhoric telah mengambil bahagian dalam penjelasannya; Contohnya, ada yang perlu untuk penjagaan kereta, produk pembersihan untuk perabot, komponen elektrik dan elektronik, dan bahan api, antara produk lain.
Rujukan
- Pubchem. (2018). Asid hidrofluorik. Diperoleh pada 3 April 2018, dari: Pubchem.NCBI.NLM.NIH.Gov.
- Hari Kat. (16 April 2013). Asid yang benar -benar memakan segalanya. Diperoleh pada 3 April 2018, dari: ChronicleFlask.com
- Wikipedia. (28 Mac, 2018). Asid hidrofluorik. Diperoleh pada 3 April 2018, dari: dalam.Wikipedia.org.
- Shiver & Atkins. (2008). Kimia bukan organik. (Edisi Keempat., p. 129, 207-249, 349, 407). MC Graw Hill.
- Asid hidrofluorik. Musc. Perubatan Universiti South Carolina. Diperoleh pada 3 April 2018, dari: Jabatan Akademik.Musc.Edu