Ciri Cysteine, Struktur, Fungsi, Biosintesis
- 2664
- 812
- Delbert Dare
The Cysteine (Cys, c) adalah salah satu daripada 22 asid amino yang terdapat di alam semula jadi sebagai sebahagian daripada rantai polipeptida yang membentuk protein makhluk hidup. Adalah penting untuk kestabilan struktur protein tertiari, kerana ia membantu pembentukan jambatan disulfida intramolekul.
Serta berlaku untuk asid amino lain seperti alanine, arginine, asparagine, glutamat dan glutamin, glisin, proline, serine dan tirosin, manusia dapat mensintesis sistein, jadi ini tidak dianggap sebagai asid amino penting.
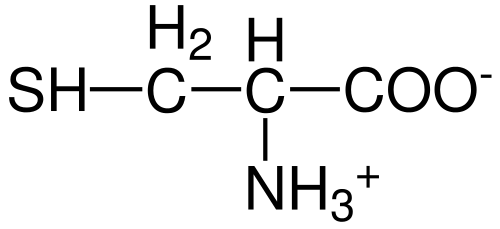
 Struktur Asid Amino Cysteine (Sumber: Hattrich [Domain Awam] melalui Wikimedia Commons)
Struktur Asid Amino Cysteine (Sumber: Hattrich [Domain Awam] melalui Wikimedia Commons) Walaupun ini, dan memandangkan fakta bahawa kadar sintesis tidak selalu membekalkan keperluan badan, beberapa penulis menggambarkan cysteine sebagai "asid amino" pada dasarnya ".
Asid amino ini dinamakan oleh "Cystina", komponen pengiraan vesikular yang ditemui pada tahun 1810, yang namanya dicipta pada tahun 1832 oleh a. Baudrimont dan f. Malaguti. Beberapa tahun kemudian, pada tahun 1884, dan. Baumann mendapati bahawa cysteine adalah hasil pengurangan sista.
Selepas kerja yang dilakukan oleh Bauman, pada tahun 1899, ditentukan bahawa cysteine adalah penyusun utama protein yang membentuk tanduk pelbagai haiwan, yang mencadangkan kemungkinan penggunaannya untuk sintesis polipeptida.
Pada masa ini diketahui bahawa sistein badan berasal dari makanan, kitar semula protein dan sintesis endogen, yang berlaku terutamanya dalam hepatosit.
[TOC]
Ciri -ciri
Cysteine mempunyai berat molekul 121.16 g/mol dan dijumpai, bersama -sama dengan leucine, isoleucine, valine, phenylalanine, tryptophan, methionine dan tyrosine, antara asid amino yang paling hidrofobik.
Ia tergolong dalam kumpulan asid amino kutub tanpa beban dan, seperti asid amino lain, ia boleh direndahkan oleh hidrolisis alkali pada suhu tinggi.
Seperti tryptophan, serine, glisin dan treonine, cysteine adalah prekursor metabolik untuk gluconeogenesis dan ketogenesis (pembentukan badan keton).
Asid amino ini wujud sebagai sebahagian daripada urutan protein peptida, tetapi juga boleh bebas dalam plasma darah sebagai disulfida homogen (cystine, derivatif) atau bercampur, terdiri daripada bentuk homocysteine-cysteine.
Perbezaan utama antara sistein percuma dan yang terdapat dalam struktur protein adalah bahawa yang pertama berada dalam keadaan redoks yang sangat berkarat, sementara yang terakhir biasanya dikurangkan.
Struktur
Seperti yang lain asid amino yang diterangkan setakat ini, sistein mempunyai atom karbon pusat, yang kiral dan dikenali sebagai karbon α.
Empat spesies kimia yang berlainan disertai dengan atom karbon ini:
- Kumpulan Amino (-NH3+)
- Kumpulan karboksil (-co-)
- atom hidrogen dan
- Substituen (-r).
Kumpulan substituen adalah yang memberikan identiti kepada setiap asid amino dan sistein dicirikan dengan mengandungi atom sulfur sebagai sebahagian daripada kumpulan Tiol Sama ada Sulfhydrillo (-Ch2-sh).

Ia adalah kumpulan ini yang membolehkannya mengambil bahagian dalam pembentukan jambatan disulfida intermolecular. Oleh kerana ia adalah nukleofil, anda juga boleh mengambil bahagian dalam tindak balas penggantian.
Sebenarnya, rantaian sampingan sistein ini boleh diubah suai untuk pembentukan dua sebatian yang dikenali sebagai "selenocysteine" dan "lantionine". Yang pertama adalah asid amino yang turut mengambil bahagian dalam pembentukan protein dan yang kedua ialah derivatif asid amino bukan protein.
Boleh melayani anda: Histones: ciri, struktur, jenis dan fungsiKumpulan Tiol Cysteine juga dicirikan oleh pertaliannya yang hebat untuk ion perak dan merkuri (Ag+ dan Hg2+).
Fungsi
Fungsi utama sistein dalam organisma hidup berkaitan dengan penyertaan mereka dalam pembentukan protein. Khususnya, sistein mengambil bahagian dalam penubuhan jambatan disulfida, yang penting untuk pembentukan struktur protein tertiari.
Di samping itu, asid amino ini bukan sahaja berguna untuk sintesis protein, tetapi juga mengambil bahagian dalam sintesis glutathione (GSH) dan menyediakan sulfur yang dikurangkan untuk methionine, asid lipoik, thiamine, coenzyme A (COA), molybdopterine (cofactor) dan lain -lain sebatian dengan kepentingan biologi.
Di bawah keadaan asid amino sulfur yang berlebihan, sistein dan asid amino yang berkaitan boleh digunakan untuk pengeluaran piruvat dan sulfur bukan organik. Pyruvate berjaya diarahkan ke arah laluan glukoneogenik, berkhidmat untuk pengeluaran glukosa.
Keratin, yang merupakan salah satu jenis protein struktur yang paling banyak di kerajaan haiwan, kaya dengan sisa sistein. Contohnya, bulu domba mengandungi lebih daripada 4% sulfur dari asid amino ini.
Cysteine juga mengambil bahagian dalam banyak tindak balas pengurangan oksida, jadi ia adalah sebahagian daripada tapak aktif beberapa enzim.
Apabila bertindak balas dengan glukosa, asid amino ini menjana produk tindak balas yang memperkenalkan citarasa dan aroma yang menarik kepada beberapa persediaan masakan.
Biosintesis
Biosintesis asid amino dalam tubuh manusia dan dalam haiwan lain (mamalia dan bukan mamalia) berlaku dalam bentuk tisu dan kelas sel; Ia adalah proses yang merangkumi tenaga dan biasanya dipisahkan di antara organ yang berbeza.
Hati adalah salah satu organ utama yang terlibat dalam sintesis asid amino yang paling tidak penting, tanpa mengira spesies yang dipertimbangkan.
Di dalam ini bukan sahaja sistein disintesis, tetapi juga aspartat, asparagine, glutamat dan glutamin, glisin, serine, tirosin dan lain -lain dari prekursor asid amino spesifiknya.
Pada tahun 1935, jenama Erwin menentukan bahawa cysteine, dalam mamalia, secara semulajadi disintesis dari metionin, yang berlaku secara eksklusif dalam tisu hati.
Proses ini boleh berlaku kerana "transmetile" metionin, di mana kumpulan metil dipindahkan ke bukit dan creatine. Walau bagaimanapun, cysteine juga boleh dibentuk dari miel terima kasih kepada transulfurasi.
Seterusnya ia ditunjukkan bahawa, sebagai tambahan kepada metionin, beberapa sebatian sintetik seperti N-asetil cysteine, cysteamine dan cystamine, adalah prekursor berguna untuk sintesis sistein.
Dalam kes cysteine N-asetil, ini diambil oleh sel-sel, di mana ia ditukar kepada sistein oleh enzim sitosol di sitosol.
Mekanisme sintesis
Mekanisme sintesis sistein dari metodin yang paling terkenal ialah trans -Ululo. Ini berlaku terutamanya di hati, tetapi ia juga telah ditentukan dalam usus dan pankreas.
Ini berlaku dari homocysteine, sebatian yang diperolehi daripada metodin asid amino; Dan reaksi pertama laluan biosintetik ini adalah pemeluwapan yang dipangkin oleh enzim cistation β-sentase (CBS) (CBS).
Boleh melayani anda: uracil: struktur, fungsi, sifat, sintesisEnzim ini mewakili laluan "komitmen" laluan dan memendekkan homocysteine dengan residu serina, satu lagi asid amino protein, yang menghasilkan cystationin. Selepas itu, sebatian ini "dipotong" atau "berpecah" oleh enzim cistationasa, yang membawa kepada pembebasan sistein.
Peraturan aktiviti enzimatik CBS dimediasi oleh ketersediaan metodin dan oleh keadaan redoks sel di mana proses ini berlaku.
Melalui laluan sintesis sistein, sel -sel dapat mengendalikan metodin yang berlebihan, kerana penukaran mereka ke sistein adalah proses yang tidak dapat dipulihkan.
Sintesis Cysteine dalam Tumbuhan dan Mikroorganisma
Dalam organisma ini, sistein disintesis terutamanya dari sulfur bukan organik, yang merupakan sumber sulfur yang paling banyak digunakan dalam biosfera aerobik.
Ini diambil, memasuki sel-sel dan kemudian dikurangkan kepada sulfida (S2-), yang dimasukkan ke dalam sistein dengan cara yang sama dengan apa yang berlaku dengan ammonium dalam sintesis glutamat atau glutamin.
Metabolisme dan degradasi
Catabolisme sistein berlaku terutamanya dalam sel hati (hepatosit), walaupun ia juga boleh berlaku dalam jenis sel lain seperti neuron, sel endothelial dan sel otot licin badan vasculature.
Kecacatan tertentu dalam katabolisme sistein menghasilkan penyakit keturunan yang dikenali sebagai "cystinuria", yang dicirikan oleh kehadiran pengiraan sistin di buah pinggang, pundi kencing dan ureter.
Cystine adalah asid amino yang diperolehi dari sistein dan pengiraan dibentuk oleh kesatuan dua molekul melalui atom sulfur mereka.
Sebahagian daripada metabolisme sistein menghasilkan pembentukan asid saintifik, dari mana banteng, asid amino bukan protein terbentuk. Tindak balasnya dipangkin oleh enzim cysteine dioxigenasa.
Di samping itu, sistein boleh dioksidakan oleh formaldehid untuk menghasilkan cysteine N-formil, yang pemprosesan seterusnya boleh membawa kepada pembentukan "barangan" (produk pemeluwapan sistein dengan sebatian aromatik).
Pada haiwan, sistein juga digunakan, serta glutamat dan glutamin, untuk sintesis koenzim A, glutathione (GSH), piruvat, sulfat dan asid sulfideric.
Salah satu kaedah untuk penukaran dari sistein ke piruvat berlaku dalam dua langkah: yang pertama menyiratkan penyingkiran atom sulfur dan yang kedua reaksi transaminasi.
Buah pinggang bertanggungjawab terhadap perkumuhan sulfat dan sulfah yang diperolehi daripada metabolisme sebatian sulfur seperti sistein, manakala paru -paru menghembus nafas sulfur dioksida dan asid sulphidrik.
Glutathion
Glutathione, molekul yang dibentuk oleh tiga sisa asid amino (glisin, glutamat dan sistein) adalah molekul yang terdapat dalam tumbuh -tumbuhan, haiwan dan bakteria.
Ia mempunyai sifat khas yang menjadikannya "penampan" redoks yang sangat baik, kerana ia melindungi sel -sel dari pelbagai jenis tekanan oksidatif.
Makanan yang kaya dengan sistein
Cysteine secara semulajadi dijumpai dalam makanan yang mengandungi belerang sebagai kuning telur (kuning) telur, lada merah, bawang putih, bawang, brokoli, kembang kol, colliflower, collils dan brussels choles, air air dan daun mustard.
Ia juga terdapat kebanyakannya dalam makanan protein seperti daging, kekacang dan produk tenusu, antaranya:
Boleh melayani anda: Ovalbumin: Struktur, Fungsi, Denaturasi- Daging lembu, daging babi, ayam dan ikan
- Oat dan lentil
- Biji bunga matahari
- Yogurt dan keju
Faedah pengambilan sistein
Dianggap bahawa pengambilannya menghalang kehilangan rambut dan merangsang pertumbuhannya. Dalam industri makanan, ia sangat digunakan sebagai ejen urut yang boleh ditanam dan juga untuk "menghasilkan semula" rasa seperti daging.
Penulis lain telah menekankan bahawa pengambilan makanan tambahan atau makanan -makanan yang kaya dengan makanan.
Beberapa suplemen pemakanan yang berkaitan dengan sistein digunakan oleh manusia sebagai antioksidan, yang dianggap bermanfaat dari sudut pandangan "kelewatan" penuaan.
Cysteine N-acetyl (prekursor dalam sintesis cysteine) misalnya, diambil sebagai suplemen pemakanan, kerana ini mengakibatkan peningkatan biosintesis glutation (GSH).
Penyakit berkaitan
Terdapat beberapa penerbitan saintifik yang mengaitkan tahap cysteine plasma yang tinggi dengan obesiti dan patologi lain yang berkaitan seperti penyakit kardiovaskular dan sindrom metabolik lain.
Cystinuria, seperti yang disebutkan di atas, adalah patologi yang berkaitan dengan kehadiran batu sistin, derivatif zip, disebabkan oleh kecacatan genetik dalam reabsorpsi asid amino dibasic seperti sistin.
Gangguan kekurangan
Kekurangan sista telah dikaitkan dengan tekanan oksidatif, kerana ini adalah salah satu prekursor utama untuk sintesis glutathione. Oleh itu, kekurangan dalam asid amino ini boleh membawa kepada penuaan pramatang dan semua flat yang bermaksud ini.
Ia telah secara eksperimen menunjukkan bahawa suplemen sistein meningkatkan fungsi otot rangka, mengurangkan hubungan antara jisim badan dan bukan fat, mengurangkan paras plasma sitokin keradangan, meningkatkan fungsi sistem imun, dll.
Pada pertengahan tahun 1990 -an, beberapa kajian mencadangkan bahawa sindrom Immunodeficiency (AIDS) yang diperolehi boleh menjadi akibat daripada kekurangan sistein yang disebabkan oleh virus.
Kenyataan ini disokong oleh fakta bahawa pesakit hi-positif yang diperiksa mempunyai tahap cystine dan sistein plasma yang rendah, sebagai tambahan kepada kepekatan intraselular glutation yang dikurangkan.
Rujukan
- Dröge, w. (1993). Kekurangan cysteine dan glutathione dalam pesakit AIDS: Rasional untuk rawatan dengan N-Aceicyl-Cysteine. Farmakologi, 46, 61-65.
- Dröge, w. (2005). Tekanan dan penuaan oksidatif: Penuaan sindrom defisis sistein? Transaksi Falsafah Persatuan Diraja B: Sains Biologi, 360(1464), 2355-2372.
- Elshorbagy, a. K., Smith, a. D., Kozich, v., & Refsum, h. (2011). Cysteine dan obesiti. Obesiti, dua puluh(3), 1-9.
- Kridich, n. (2013). Biosintesis cysteine. Ecosal Plus, 1-30.
- McPherson, r. Ke., & Hardy, G. (2011). Manfaat Klinikal dan Pemakanan dari suplemen protein yang diperkaya cysteine. Pendapat semasa dalam pemakanan klinikal dan penjagaan metabolik, 14, 562-568.
- Mokhtari, v., Afsharian, ms., Shahhoseini, m., Kalantar, s. M., & Moini, a. (2017). Kajian semula mengenai pelbagai kegunaan N-acetyl Cysteine. Jurnal Sel, 19(1), 11-17.
- Piste, ms. (2013). Antioksidan Cysteine-Master. Jurnal Antarabangsa Sains Farmaseutikal, Kimia dan Biologi, 3(1), 143-149.
- Quig, d. (1998). Metabolisme sistein dan ketoksikan logam. Kajian Perubatan Alternatif, 3(4), 262-270.
- Wu, g. (2013). Asid Aminino. Biokimia dan pemakanan. Boca Raton, FL: Kumpulan Taylor & Francis.
- « Ciri -ciri Pembelajaran Sosial, Teori Bandura, Contoh
- Dimensi pendidikan sosio -emosi, kepentingan, prasekolah »

