Aluminium Chloride (ALCL3)

- 719
- 122
- Erick Krajcik
 Formula dan struktur aluminium klorida
Formula dan struktur aluminium klorida Apa itu Aluminium Chloride?
Dia Aluminium chloride Ia adalah sebatian kimia bukan organik yang formulanya adalah ALCL3. Ia dibentangkan sebagai habuk pepejal atau putih, walaupun disebabkan pencemaran dengan klorida ferrik, dan kelembapan, ia boleh menjadi kuning. Ia terdiri daripada asid Lewis, tetapi dalam keadaan tertentu ia juga bertindak sebagai pangkalan Lewis.
Walaupun aluminium sebagai logam dalam jadual berkala, terdapat ikatan kovalen antara aluminium dan klorin untuk membentuk aluminium klorida.
Ikatan kovalen ini dapat menjelaskan mengapa aluminium chloride cair adalah konduktor elektrik yang buruk; Walaupun garam lebur sebatian lain, seperti natrium klorida, adalah konduktor elektrik yang baik.
Aluminium klorida dihasilkan oleh tindak balas eksotermik antara aluminium dan klorin, atau hidrogen klorida, pada suhu antara 650 dan 750 ºC.
Aluminium klorida digunakan sebagai antitranspirant dan untuk memerangi peluh yang berlebihan. Salah satu derivatifnya digunakan sebagai agen koagulan dalam rawatan air sisa perindustrian, dan juga digunakan sebagai pemangkin utama dalam reaksi kimia industri.
Struktur klorida aluminium
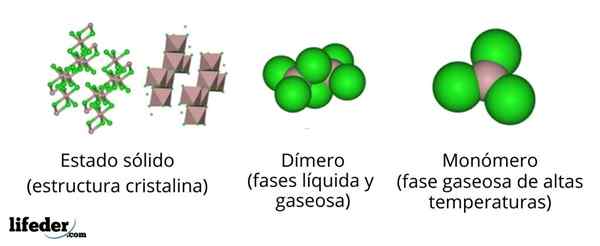
Dalam imej atas kita mempunyai perwakilan yang berbeza untuk setiap struktur kristal atau molekul yang mempamerkan aluminium klorida anhydrous, ALCL3, Di beberapa keadaan fizikalnya.
ALCL3 pepejal terdiri daripada struktur kristal monoklinik yang dibentuk oleh lapisan oktaedros yang diselaraskan antara satu sama lain. Dalam octahedra ini (warna coklat), ion ke3+ Ia diselaraskan dengan enam cl ion-, Bertindak klorida sebagai jambatan antara dua octahedra.
Apabila suhu meningkat dan alll ditubuhkan3, Lapisan dipisahkan menjadi unit ke2Cl6 (Pusat Imej). Sekarang, atom aluminium membentuk pautan dengan tiga atom klorin dan pautan dengan atom aluminium yang lain: CL3Al-Alcl3. Dimer ini menjelaskan mengapa ALCL3 cair kurang padat daripada kristalnya.
Boleh melayani anda: Gadolinio: struktur, sifat, mendapatkan, menggunakanDalam fasa stim, dimer ke2Cl6 Mereka menjauhkan satu sama lain. Tetapi jika stim ini tertakluk kepada suhu tinggi, dimer memisahkan dalam unit molekul ALCL3, di mana atom aluminium membentuk tiga pautan dengan atom klorin. ALCL3 membentangkan geometri rata trigonal.
Sifat klorida aluminium
 Sampel pepejal klorida aluminium dengan nada kekuningan. Sumber: Xlollitox, CC oleh 3.0, melalui Wikimedia Commons
Sampel pepejal klorida aluminium dengan nada kekuningan. Sumber: Xlollitox, CC oleh 3.0, melalui Wikimedia Commons Formula
ALCL3 (anhydrous)
ALCL3· 6h2O (hexahydrate)
Jisim molar
133.34 g/mol (anhydro)
241.43 g/mol (hexahydrate)
Penampilan fizikal
Debu pepejal atau putih kristal. Ia boleh menjadi warna kekuningan kerana pencemaran dengan ferric chloride. Anda juga boleh berubah menjadi warna kelabu untuk kelembapan.
Takat lebur
192.4 ºC
Takat didih
Sublima pada 178 ºC, jadi tidak mudah untuk mendapatkan titik mendidih aluminium klorida.
Ketumpatan
2.48 g/cm3 (anhydrous)
2.398 g/cm3 (Hexahydrate)
Kelarutan air
439 g/l A 0 ºC
458 g/l pada 20 ºC
466 g/l 30 ºC
Aluminium Chloride adalah sebatian hygroscopic yang dapat menyerap air udara basah, memancarkan asap semasa proses.
Kelarutan dalam pelarut lain
Ethanol larut, kloroform, karbon tetrachloride, benzofenone dan nitrobenzene. Sedikit larut dalam benzena.
Tekanan wap
13.3 kPa pada 151 ºC (0.131 atm).
Goo
0.35 cp hingga 197 ºC
Reaktiviti
Aluminium klorida adalah bahan amphotate, iaitu, ia berkelakuan seperti asid atau asas. Walau bagaimanapun, tindakannya sebagai asid adalah lebih penting, kerana aluminium klorida digunakan sebagai asid Lewis dan pada masa yang sama adalah pemangkin dalam banyak reaksi kimia; Antara mereka, reaksi Friedel-Crafts.
Boleh melayani anda: Neodymium: struktur, sifat, kegunaanMalah klorida aluminium diklasifikasikan sebagai asid, bukannya melakukannya sebagai garam.
Aluminium klorida anhydrous dalam larutan berair diubah menjadi garam hexahydrate (ALCL3· 6h2O), yang tidak kembali ke bentuk anhydrous dengan pemanasan.
Atom aluminium dari dua molekul ALCL3 Mereka berinteraksi antara satu sama lain untuk melengkapkan 8 elektron dalam lapisan valensi mereka, yang menghasilkan pembentukan dimer ke2Cl6. Dimer ini terdapat dalam cloride aluminium cair dan wap.
Aluminium klorida bertindak balas dengan natrium hidroksida untuk membentuk aluminium hidroksida, mendakan gelatin:
ALCL3 + Naoh → Al (oh)3 + 3 NaCl
Aplikasi Aluminium Chloride
Antitranspirant dan antihemorrhagic
 Aluminium Chloride adalah sebahagian daripada bahan -bahan yang digunakan dalam formulasi beberapa deodoran. Sumber: TH145, CC BY-SA 2.0, melalui Wikimedia Commons
Aluminium Chloride adalah sebahagian daripada bahan -bahan yang digunakan dalam formulasi beberapa deodoran. Sumber: TH145, CC BY-SA 2.0, melalui Wikimedia Commons Aluminium Chloride digunakan sebagai antitranspirant dalam deodoran peribadi, dan juga digunakan untuk mengawal peluh yang berlebihan (hyperhidrosis). Ia juga digunakan dalam formulasi untuk mengawal pendarahan kecil, seperti yang dibentangkan dalam rawatan pergigian.
Rawatan kumbahan
Aluminium klorida dalam bentuk PAC (polyalumin chloride), digunakan sebagai koagulan dalam rawatan air sisa perindustrian, kerana keupayaannya untuk menjelaskan air dan enapcemar dehidrat.
Pemangkin
Aluminium Chloride adalah salah satu pemangkin utama yang digunakan dalam industri, bertindak sebagai pemangkin dalam banyak reaksi, termasuk Friedel-Crafts.
Boleh melayani anda: Europium: struktur, sifat, mendapatkan, menggunakanAluminium Chloride memangkinkan tindak balas penyediaan antraquinones, beberapa di antaranya digunakan dalam industri tekstil. Terdapat juga antraquinones yang mempunyai sifat antibakteria, antiparasit, fungicidal dan antiviral.
Aluminium klorida memangkinkan tindak balas yang dihasilkan oleh dodecilbenzene, yang digunakan dalam pengeluaran detergen, dan etilbenzena, kompaun yang digunakan dalam pembuatan polistirena, polimer yang digunakan dalam penjelasan plastik, resin dan getah.
Aluminium klorida juga digunakan sebagai pemangkin dalam tindak balas yang merupakan sebahagian daripada pengeluaran petrol oktana yang tinggi. Begitu juga, memangkinkan proses retak minyak.
Risiko
Aluminium klorida adalah bahan yang menghakis dan hubungannya boleh menyebabkan kerengsaan dan kecederaan kulit dan mata, menghasilkan kerosakan mata.
Apabila membubarkan di dalam air, gas beracun boleh dibebaskan, seperti hidrogen klorida; gas yang mampu menyedut kerengsaan hidung dan tekak, dapat menyebabkan kerengsaan yang sukar dan paru -paru. Kerengsaan ini boleh menyebabkan pengumpulan cecair di paru -paru (edema pulmonari), yang berakhir dengan kecemasan perubatan.
Ia telah cuba mewujudkan hubungan antara penyakit Alzheimer dan aluminium klorida; Walaupun hasil penyelidikan tidak muktamad.
Begitu juga, hubungan antara penggunaan deodoran yang mereka gunakan sebagai anti -transpirant ke Alll telah disiasat3 dan barah payudara. Penyelidikan belum dapat menunjukkan hubungan yang konklusif. Walau apa pun, aluminium klorida menghalang operasi sistem detoksifikasi semula jadi organisma dan pelepasan haba, seperti peluh.
Rujukan
- Wikipedia. (2021). Aluminium klorida. Diperoleh dari: dalam.Wikipedia.org
- Pusat Kebangsaan Maklumat Bioteknologi (2021). Aluminium Klorida, Ringkasan Kompaun Pubchem untuk CID 24012. Pulih dari: pubchem.NCBI.NLM.NIH.Gov
- Kesihatan NJ. (2008). Lembaran Fakta Bahan Bahaya: Aluminium Klorida. [Pdf]. Pulih dari: NJ.Gov
- Britannica Encyclopaedia. (2021). Aluminium klorida. Pulih dari: Britannica.com
- Elsevier b.V. (2021). Anthraquinones. Scientedirect. Diperoleh dari: Scientedirect.com
- John p. Cunha. (02 Mei, 2020). Aluminium klorida topikal. Pulih dari: rxlist.com

