Struktur klorida besi (iii), sifat, mendapatkan, menggunakan
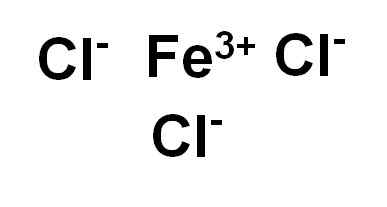
- 4794
- 165
- Donnie Ryan
Dia Besi klorida (iii) Ia adalah sebatian bukan organik yang dibentuk oleh besi (iman) dan elemen klorin (CL). Formula kimianya adalah FECL3. Ia adalah pepejal kristal yang warna boleh dari oren hingga coklat hitam.
FECL3 Ia mudah dibubarkan dalam air yang membentuk penyelesaian berair berasid di mana dengan meningkatkan pH menjadikannya lebih beralkali.
 Besi klorida (III) atau ferric chloride fecl3 pepejal. Е г г н н/cc by-sa (https: // creativeCommons.Org/lesen/by-sa/3.0). Sumber: Wikimedia Commons.
Besi klorida (III) atau ferric chloride fecl3 pepejal. Е г г н н/cc by-sa (https: // creativeCommons.Org/lesen/by-sa/3.0). Sumber: Wikimedia Commons. Besi klorida (iii) digunakan untuk sedimen zarah yang mencemarkan air sisa perbandaran atau industri. Dikatakan bahawa ia membolehkan anda mengeluarkan beberapa parasit dan berkhidmat untuk menghentikan kehilangan darah dari haiwan pada haiwan dan untuk penyembuhan ini.
Ia berfungsi untuk mengekstrak tembaga (ii) mineral sulfida tembaga. Ia juga digunakan dalam pelbagai tindak balas kimia dan analisis makmal biologi dan kimia. Sebagai contoh, ia berfungsi untuk mengesan sebatian sebagai fenol dalam minyak yang diekstrak dari tumbuhan. Ia digunakan dalam litar elektronik, di kulit kulit dan dalam fotografi.
Kerana menjadi FECL3 Sebatian asid menghakis untuk membran kulit dan mukus. Debu sebatian ini mesti dielakkan. Ia tidak boleh dibuang ke persekitaran.
[TOC]
Struktur
Besi klorida (III) atau ferric chloride fecl3 Ia adalah sebatian ionik dan dibentuk oleh iman ferrik3+ dan tiga ion klorida cl-. Besi berada dalam keadaan pengoksidaannya +3 dan setiap klorin mempunyai Valencia -1.
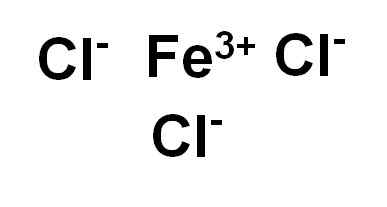 Besi klorida (iii) atau ferric chloride. Pengarang: Marilú Stea.
Besi klorida (iii) atau ferric chloride. Pengarang: Marilú Stea. Nomenclature
- Besi klorida (iii)
- Ferric Chloride
- Iron Trichloride
- Muriature besi
Sifat
Keadaan fizikal
Oren pepejal kristal hingga coklat hitam.
 Ferric Chloride Fecl3 anhydrous (tanpa air). Leiem/cc by-sa (https: // creativeCommons.Org/lesen/by-sa/4.0). Sumber: Wikimedia Commons.
Ferric Chloride Fecl3 anhydrous (tanpa air). Leiem/cc by-sa (https: // creativeCommons.Org/lesen/by-sa/4.0). Sumber: Wikimedia Commons. Berat molekul
Anhidro Fecl3 = 162.2 g/mol
Takat lebur
Anhidro Fecl3 = 304 ºC
Hexahydrate Fecl3 •6H2O = 37 ° C
Takat didih
Anhidro Fecl3 = Kira -kira 316 ºC
Hexahydrate Fecl3 •6H2O = 280-285 ° C
Ketumpatan
Anhidro Fecl3 = 2.90 g/cm3 pada 25 ° C
Kelarutan
Sangat larut dalam air: 74.4 g/100 g air pada 0 ° C; 535.7 g/100 g air pada 100 ° C. Sangat larut dalam aseton, etanol, eter dan metanol. Larutan larut dalam pelarut non -polar seperti benzena dan heksana.
Boleh melayani anda: boron: sejarah, sifat, struktur, kegunaanPh
Penyelesaian berairnya sangat berasid. Penyelesaian 0.1 mol FECL3 seliter air mempunyai pH 2.0.
Sifat kimia
Apabila FADL larut di dalam air3 Ia dihidrolisiskan; iaitu, ia memisahkan ion imannya3+ dan 3 cl-. Iman3+ Bentuk hexaacuohierro ion [iman (h2Sama ada)6]3+ Tetapi ini digabungkan dengan ion OH- air yang membentuk spesies campuran dan melepaskan proton h+.
Atas sebab ini penyelesaian mereka berasid. Sekiranya pH semakin meningkat, spesies ini membentuk gel dan akhirnya mendakan atau pepejal iman oksida terhidrat terbentuk2Sama ada3 •NH2Sama ada.
Kristal klorida besi (III) adalah hygroscopic, iaitu, mereka menyerap air dari alam sekitar. Apabila basah, ia menghakis untuk aluminium dan banyak logam.
 Penyelesaian FECL3 Mereka boleh menjadi sangat berasid dan menghakis, kerana ia mengandungi HCl. Kanesskong/CC BY-SA (https: // creativeCommons.Org/lesen/by-sa/4.0). Sumber: Wikimedia Commons.
Penyelesaian FECL3 Mereka boleh menjadi sangat berasid dan menghakis, kerana ia mengandungi HCl. Kanesskong/CC BY-SA (https: // creativeCommons.Org/lesen/by-sa/4.0). Sumber: Wikimedia Commons. Penyelesaian berair FECL3 Mereka sangat berasid dan menghakis untuk kebanyakan logam. Mereka mempunyai bau asid hidroklorik HCl yang lemah. Apabila FECL dipanaskan sehingga penguraiannya3 memancarkan gas HCl yang sangat beracun.
Memperoleh
Besi klorida (III) dihasilkan oleh pengklorinan langsung besi dengan bertindak balas klorin kering (CL2) Dengan sekerap besi (iman) pada suhu 500-700 ° C.
Tindak balas dilakukan dalam reaktor asid -restrik. Langkah pertama adalah mencairkan pada suhu 600 ° C campuran besi klorida (III) (FECL3) dan kalium klorida (KCl).
 FECL3 Ia mesti disediakan dalam bekas yang sangat tahan terhadap asid seperti keluli tahan karat. Pengarang: Johannes Plenio. Sumber: Pixabay.
FECL3 Ia mesti disediakan dalam bekas yang sangat tahan terhadap asid seperti keluli tahan karat. Pengarang: Johannes Plenio. Sumber: Pixabay. Kemudian sekerap besi (iman) dibubarkan dalam campuran cair di mana besi bertindak balas dengan FECL3 Dan ia menjadi ferus klorida (FECL2).
FE + 2 FECL3 → 3 FECL2
Kemudian FECL2 bertindak balas dengan klorin cl2 membentuk FECL3 yang sublimates (berlalu dari keadaan pepejal ke gas secara langsung) dan dikumpulkan di ruang pemeluwapan khas.
2 FECL2 + Cl2 → 2 FECL3
Anda juga boleh bertindak balas ferus feso sulfat4 dengan klorin cl2.
Hexahydrate Fecl3 •6H2O Ia dapat diperoleh dengan menguap penyelesaian ion iman yang berair3+ dan Cl- Dalam mandi stim.
Boleh melayani anda: Sebatian Quaternary: Ciri, Latihan, ContohKehadiran dalam alam
Ferric chloride atau besi klorida (iii) didapati dalam bentuk dalam bentuk mineral mo -mineral, yang terdapat di lava fumaroles gunung berapi aktif. Antara gunung berapi di mana anda dapat mencari ialah Gunung Vesubio.
 FECL3 Ia adalah sebahagian daripada bijih Moysite yang berada di gunung berapi aktif. Pengarang: Skeze. Sumber: Pixabay.
FECL3 Ia adalah sebahagian daripada bijih Moysite yang berada di gunung berapi aktif. Pengarang: Skeze. Sumber: Pixabay. Aplikasi
Dalam rawatan air sisa
Ferric Chloride digunakan untuk merawat air kumbahan perbandaran atau perindustrian melalui pemendapan kimia.
Ia bertindak sebagai koagulan yang memihak kepada kesatuan beberapa zarah antara satu sama lain, dengan cara ini konglomerat atau zarah yang lebih besar dibentuk yang cenderung floccular atau sedimen (menurunkan berat badan mereka sendiri ke bahagian bawah air yang sedang dirawat).
 FECL3 Ia digunakan untuk memisahkan bahan yang tidak diingini dari perairan yang dibuang oleh komuniti atau industri. Pengarang: 后园 卓. Sumber: Pixabay.
FECL3 Ia digunakan untuk memisahkan bahan yang tidak diingini dari perairan yang dibuang oleh komuniti atau industri. Pengarang: 后园 卓. Sumber: Pixabay. Dengan cara ini pemisahan pepejal air disukai dan ini bebas daripada bahan yang tidak diingini.
Rawatan jenis ini dapat memudahkan penyingkiran parasit, seperti protozoa, yang merupakan mikroorganisma yang dibentuk oleh sel tunggal, seperti amibas, yang menyebabkan penyakit.
Atas sebab ini FECL3 Ia juga digunakan untuk membersihkan air.
Dalam prosedur penyembuhan veterinar
Besi klorida (III) digunakan untuk menyembuhkan kecederaan haiwan.
Ia berfungsi sebagai astringen tempatan (anda boleh menarik tisu dan bertindak sebagai anti -radang dan penyembuhan) dan hemostatic (ia berhenti pendarahan atau kehilangan darah).
Ia digunakan dalam serbuk untuk menghentikan kehilangan darah atau ketika kuda dipotong ke lembu. Ia juga digunakan dalam penyelesaian untuk menghentikan pendarahan apabila cakar dipotong atau ketuat dihapuskan.
 FECL3 Ia digunakan dalam serbuk yang digunakan untuk lembu memotong tanduk dan elakkan jangkitan. Pengarang: Jaclou DL. Sumber: Pixabay.
FECL3 Ia digunakan dalam serbuk yang digunakan untuk lembu memotong tanduk dan elakkan jangkitan. Pengarang: Jaclou DL. Sumber: Pixabay. Ia juga digunakan untuk merawat pharyngitis (keradangan pharynx) atau stomatitis (keradangan mukosa oral) dan meningkatkan hemoglobin darah pada beberapa burung.
Dalam pengekstrakan logam
Besi klorida (III) atau ferric chloride fecl3 Ia digunakan untuk mengekstrak tembaga (ii) bijih tembaga yang mengandungi sulfida logam tersebut.
Boleh melayani anda: hidroksidaIa adalah kaedah oksidatif yang mencukupi untuk mengelakkan pembebasan sulfur dioksida gas toksik (begitu2), kerana bukannya ini dihasilkan sulfur (s). Penyelesaian dengan kepekatan FECL yang tinggi dihasilkan2, FECL3, Cucl2 dan klorida logam lain.
4 FECL3 + Cu2S ⇔ 4 FECL2 + 2 Cucl2 + S ↓
Sebagai reagen makmal kimia dan biologi
Di antara banyak kegunaan kimianya berfungsi untuk menunjukkan kehadiran kumpulan fenolik (iaitu, kumpulan -OH dilampirkan pada cincin benzena).
Kompaun dibubarkan untuk dianalisis dalam etanol dan beberapa tetes penyelesaian FECL ditambah3. Apabila kompaun mempunyai kumpulan -OH yang dilampirkan pada cincin benzena (iaitu, ia adalah fenol) warna hijau kebiruan terbentuk.
Ujian ini membolehkan untuk menganalisis kehadiran fenol dalam ekstrak tumbuhan.
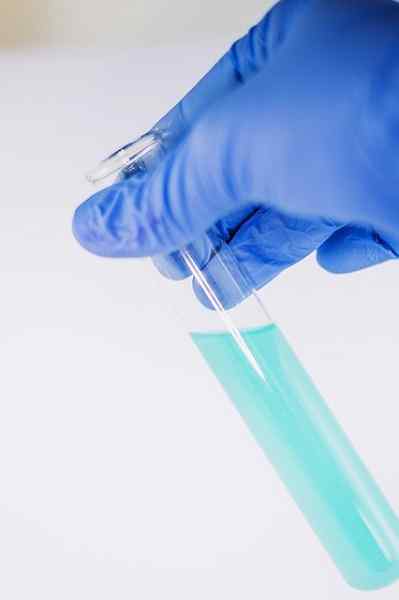 FECL3 Di hadapan fenol, ia memberikan warna hijau kebiruan. Pengarang: Ewa Urban. Sumber: Pixabay.
FECL3 Di hadapan fenol, ia memberikan warna hijau kebiruan. Pengarang: Ewa Urban. Sumber: Pixabay. Ia juga digunakan dalam ujian untuk menentukan aktiviti antioksidan minyak tertentu yang diekstrak dari sayur -sayuran.
Satu lagi aplikasinya ialah ia membolehkan untuk menyediakan sebatian kimia lain. Ia juga boleh bertindak sebagai ejen pengoksidaan, klorinasi (menyediakan klorin) dan kondensor (untuk menyertai dua atau lebih molekul antara satu sama lain).
Ia juga berfungsi sebagai pemangkin atau pemecut tindak balas kimia organik.
Dalam beberapa aplikasi
Ferric Chloride digunakan dalam litar elektronik bercetak. Dengan pewarnaan pelbagai bentuk terhidratnya ia berfungsi sebagai pigmen dan digunakan dalam penyamak kulit.
 FECL3 Ia digunakan dalam penyamakan kulit. Pengarang: Pexels. Sumber: Pixabay.
FECL3 Ia digunakan dalam penyamakan kulit. Pengarang: Pexels. Sumber: Pixabay. Ia disinfektan. Ia digunakan untuk merawat gangguan kulit dan juga digunakan dalam fotografi.
Risiko
Serbuk FECL3 Ia menjengkelkan untuk mata, hidung dan mulut. Sekiranya menghirup boleh menyebabkan batuk atau kesukaran bernafas. Ia adalah sebatian yang menghakis, jadi hubungan yang berpanjangan dengan kulit dan dengan mata atau membran mukus boleh menyebabkan kemerahan dan luka bakar.
Ia tidak mudah terbakar, tetapi apabila dipanaskan pada suhu tinggi menghasilkan gas hidrogen klorida HCl, yang beracun dan sangat menghakis.
FECL3 Ia berbahaya kepada organisma akuatik dan tanah. Sekiranya secara tidak sengaja dibuang ke alam sekitar, keasidannya dengan sebatian asas mesti dinetralkan.
Rujukan
- Atau.S. Perpustakaan Perubatan Negara. (2019). Ferric Chloride. Pulih dari pubchem.NCBI.NLM.NIH.Gov.
- Kirk-Othmer (1994). Ensiklopedia Teknologi Kimia. Jilid 19. Edisi keempat. John Wiley & Sons.
- Ensiklopedia Kimia Perindustrian Ullmann. (1990). Edisi Kelima. Jilid A22. VCH Verlagsgellschaft MBH.
- Ngameni, b. et al. (2013). Flavonoid dan sebatian yang berkaitan dari tumbuhan ubat Afrika. Pencirian flavonoid dalam ekstrak tumbuhan. Ujian Ferric Chloride. Dalam penyelidikan tumbuhan ubat di Afrika. Pulih dari Scientedirect.com.
- Agyare, c. et al. (2017). Petroselinum crispum: ulasan. Aktiviti antioksidan. Di Spartes dan Sayuran Perubatan dari Afrika. Pulih dari Scientedirect.com.
- Stott, r. (2003). Nasib dan tingkah laku parasit dalam sistem rawatan air sisa. Pemendapan pembantu kimia. Dalam Buku Panduan Mikrobiologi Air dan Air Sisa. Pulih dari Scientedirect.com.
- Tasker, ms.Ke. et al. (2003). Aplikasi Kimia Penyelarasan. Pengekstrakan CuIi Dari penyelesaian klorida. Dalam memahami kimia koordinasi. Pulih dari Scientedirect.com.
- Kapas, f. Albert dan Wilkinson, Geoffrey. (1980). Kimia bukan organik maju. Edisi keempat. John Wiley & Sons.

