Mekanisme kakisan galvanik, contoh, perlindungan

- 2573
- 806
- Ms. Edgar Carroll
The Kakisan galvanik atau elektrokimia Ini adalah proses yang mana logam atau aloi terdegradasi lebih terperinci berbanding dengan pengoksidaan konvensionalnya. Ia boleh dikatakan bahawa ia adalah pengoksidaan dipercepatkan, dan juga sengaja diketuai; Seperti dalam bateri atau bateri.
Ini berlaku di bawah satu siri syarat. Pertama, mesti ada logam aktif, yang dipanggil Anode. Juga, dan kedua, mesti ada logam mulia reaktif yang dipanggil katod. Keadaan ketiga dan keempat adalah kehadiran medium di mana elektron tersebar, seperti air, dan spesies ionik atau elektrolit.
 Mahkota besi teroksida. Sumber: Pixnio.
Mahkota besi teroksida. Sumber: Pixnio. Kakisan galvanik dapat dilihat terutamanya dalam persekitaran laut atau di tebing pantai. Arus udara mengangkat jisim wap air, yang seterusnya, menyeret beberapa ion; Yang terakhir akhirnya mematuhi lapisan air nipis atau jatuh yang terletak di permukaan logam.
Keadaan kelembapan dan kemasinan ini memihak kepada kakisan logam. Ia.
Kemudahan bahawa logam perlu mengoksida berbanding dengan yang lain boleh diukur secara kuantitatif melalui potensi pengurangannya; Di dalam buku kimia terdapat banyak meja dengan potensi ini dan. Semakin negatif, semakin besar kecenderungan anda untuk mengoksidakan.
Juga, jika logam ini berada di hadapan orang lain dengan potensi pengurangan yang sangat positif, oleh itu mempunyai ΔE yang besar, pengoksidaan logam reaktif akan menjadi lebih agresif. Faktor lain, seperti pH, daya ionik, kelembapan, kehadiran oksigen, dan hubungan antara kawasan logam yang dioksidakan dan yang dikurangkan, juga penting.
[TOC]
Mekanisme
Konsep dan tindak balas
Sebelum menangani mekanisme di sebalik kakisan galvanik, konsep tertentu mesti dijelaskan.
Dalam reaksi Rédox spesies kehilangan elektron (teroksida) sementara yang lain memenanginya (ia dikurangkan). Elektrod di mana pengoksidaan berlaku dipanggil anod; Dan di mana pengurangan itu berlaku, katod (dalam bahasa Inggeris peraturan nemonik biasanya digunakan Redcat untuk mengingati).
Oleh itu, untuk elektrod (satu bahagian, skru, dll.) dari logam m, jika ini dioksidakan, dikatakan bahawa ia adalah anod:
M => mn+ + ne-
Bilangan elektron yang dikeluarkan akan sama dengan magnitud beban positif kation mn+ Hasilnya.
Kemudian, satu lagi elektrod atau logam (kedua -dua logam mesti bersentuhan dalam beberapa cara), menerima elektron yang dikeluarkan; Tetapi ini tidak mengalami tindak balas kimia jika mereka mendapat elektron, kerana ia hanya akan menjalankannya (arus elektrik).
Oleh itu, mesti ada spesies lain dalam penyelesaian bahawa elektron ini secara rasmi dapat menerima; Mudah untuk mengurangkan ion logam, sebagai contoh:
Boleh melayani anda: Sistem tidak masuk akalRn+ + ne- => R
Iaitu, lapisan logam r akan terbentuk dan elektrod akan menjadi lebih berat; Walaupun logam m akan kehilangan jisim kerana atom mereka dibubarkan.
Depolarizer
Dan jika tidak ada kation logam yang dapat dikurangkan dengan cukup? Dalam hal ini, spesies lain yang terdapat di tengah akan mengambil elektron: depolarizadores. Ini berkaitan dengan ph: o2, H+, Oh- dan h2Sama ada.
Oksigen dan elektron keuntungan air dalam tindak balas yang dinyatakan oleh persamaan kimia berikut:
Sama ada2 + 2h2O + 4E- => 4OH-
Manakala iones h+ Mereka berubah menjadi h2:
2h+ + 2e- => H2
Iaitu, oh spesies- dan h2 Mereka adalah produk biasa dari kakisan galvanik atau elektrokimia.
Walaupun logam r tidak mengambil bahagian dalam sebarang tindak balas, hakikatnya menjadi lebih mulia yang M mempromosikan pengoksidaannya; Dan akibatnya, akan ada pengeluaran oh ion yang lebih besar- o gas hidrogen. Kerana, selepas semua, ia adalah perbezaan antara potensi pengurangan, ΔE, salah satu enjin utama proses ini.
Kakisan besi
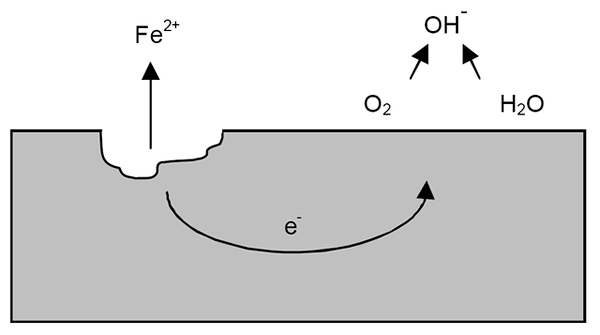 Mekanisme kakisan untuk besi. Sumber: Wikipedia.
Mekanisme kakisan untuk besi. Sumber: Wikipedia. Selepas penjelasan sebelumnya, contoh kakisan besi (imej unggul) dapat ditangani. Katakan terdapat lapisan air nipis di mana oksigen larut. Tanpa kehadiran logam lain, ia akan menjadi depolarizadores yang akan menandakan garis panduan reaksi.
Oleh itu, besi akan kehilangan beberapa atom di permukaannya untuk membubarkan air sebagai kation iman2+:
Fe => Iman2+ + 2e-
Kedua -dua elektron akan mengembara sekeping besi untuk menjadi konduktor elektrik yang baik. Supaya diketahui di mana pengoksidaan atau tapak anodik bermula; Tetapi tidak di mana pengurangan atau lokasi tapak katodik akan diteruskan. Tapak katodik boleh berada di mana sahaja; Dan semakin tinggi kawasannya yang mungkin, lebih buruk akan menjadi kakisan logam.
Katakan elektron mencapai titik seperti yang ditunjukkan dalam gambar atas. Ada oksigen dan air menderita reaksi yang telah diterangkan, yang mana OH dibebaskan-. Anion ini oh- Mereka boleh bertindak balas dengan iman2+ Untuk membentuk iman (oh)2, yang mendahului dan mengalami pengoksidaan berikutnya yang akhirnya mengubahnya menjadi karat.
Sementara itu, tapak anodik semakin retak.
Contoh
Dalam kehidupan seharian, contoh -contoh kakisan galvanik. Kita tidak perlu merujuk kepada mahkota besi: sebarang artifak yang diperbuat daripada logam boleh mengalami proses yang sama dengan kehadiran persekitaran basah dan garam.
Boleh melayani anda: kumpulan fosfatDi samping pantai, musim sejuk juga boleh menyumbang keadaan yang ideal untuk kakisan; Contohnya, apabila anda membuang garam ke salji jalan untuk mengelakkan kereta dari meluncur.
Dari sudut pandangan fizikal, dalam kesatuan yang dikimpal dua logam ia dapat mengekalkan kelembapan, menjadi tapak kakisan aktif. Ini kerana kedua -dua logam berkelakuan seperti dua elektrod, dan yang paling reaktif akan kehilangan elektron mereka.
Sekiranya pengeluaran oh ion- Ia cukup besar, anda juga boleh menjalankan cat kereta atau artifak yang dipersoalkan.
Indeks anodik
Seseorang boleh membina contoh mereka sendiri tentang kakisan galvanik menggunakan jadual potensi pengurangan. Walau bagaimanapun, jadual indeks anodik (dipermudahkan dengan sendirinya) akan dipilih untuk menggambarkan perkara ini.
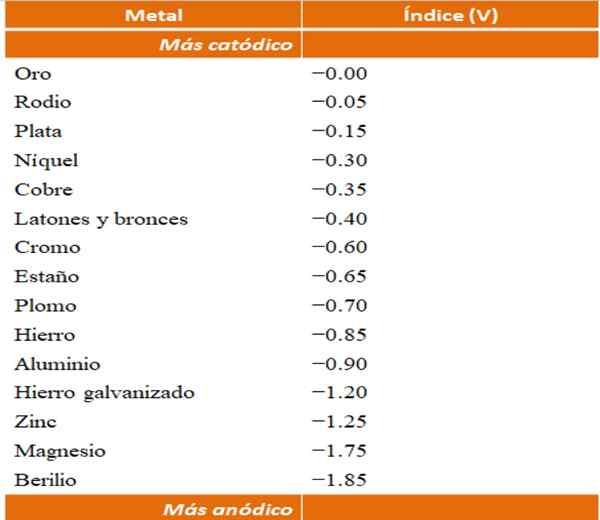 Indeks anodik untuk logam atau aloi yang berbeza. Sumber: Wikipedia.
Indeks anodik untuk logam atau aloi yang berbeza. Sumber: Wikipedia. Katakan sebagai contoh bahawa kami ingin membina sel elektrokimia. Logam yang merupakan bahagian atas jadual indeks anodik lebih banyak katod; iaitu, mereka mudah dikurangkan dan oleh itu sukar untuk memilikinya dalam penyelesaian. Walaupun logam yang berada di bahagian bawah lebih banyak anodik atau reagen, dan mudah berjalan.
Sekiranya kita memilih emas dan berilium, kedua -dua logam tidak dapat bersama -sama untuk masa yang lama, kerana berilium akan mengoksida dengan pesat yang melampau.
Dan jika sebaliknya kita mempunyai penyelesaian ion ag+ Dan kami membenamkan bar aluminium di dalamnya, ia akan larut pada masa yang sama yang menimbulkan zarah perak logam. Sekiranya bar ini menghubungkan ke elektrod grafit, elektron akan pergi ke dalamnya secara elektrokimia deposit perak seperti filem perak.
Dan jika bukan bar aluminium keluar dari tembaga, penyelesaiannya akan menjadi kebiruan dengan kehadiran ion CU2+ dalam air.
Perlindungan terhadap kakisan elektrokimia
Pengorbanan salutan
Katakan ia bertujuan untuk melindungi lamina kakisan di hadapan logam lain. Pilihan yang paling mudah adalah untuk menambah magnesium, yang akan meliputi zink supaya, sekali teroksida, elektron yang dikeluarkan dari magnesium mengurangkan kation Zn2+ Kembali.
Walau bagaimanapun, filem MGO mengenai zink lebih cepat daripada kemudian akan berakhir retak, menyediakan tapak semasa yang tinggi; iaitu, kakisan zink akan mempercepatkan secara mendadak tepat pada mata tersebut.
Teknik perlindungan terhadap kakisan elektrokimia dikenali sebagai penggunaan pelapisan pengorbanan. Yang paling terkenal adalah zink, digunakan dalam teknik terkenal yang disebut galvanisasi. Di dalamnya, Metal M dilindungi, terutamanya besi, zink (iman/Zn).
Boleh melayani anda: Phenolphthalein (C20H14O4)Sekali lagi, zink mengoksidakan dan oksidanya berfungsi untuk menutupi besi dan menghantar elektron yang mengurangkan iman2+ yang boleh dibentuk.
Salutan mulia
Katakan lagi bahawa anda ingin melindungi lembaran zink yang sama, tetapi sekarang kromium akan digunakan dan bukannya magnesium. Kromium lebih mulia (lebih banyak katodik, lihat jadual indeks anodik) daripada zink, dan itulah sebabnya ia berfungsi sebagai salutan mulia.
Masalah salutan jenis ini adalah bahawa apabila ia retak, ia akan mempromosikan dan terus mempercepatkan pengoksidaan logam di bawah; Dalam kes ini, zink berkarat lebih daripada ditutup dengan magnesium.
Dan akhirnya, terdapat salutan lain yang terdiri daripada lukisan, plastik, antioksidan, lemak, resin, dll.
Percubaan kanak -kanak
Plat besi dalam garam tembaga
Percubaan mudah boleh dirancang dari jadual indeks anodik yang sama. Melarutkan jumlah yang berpatutan (kurang daripada 10 gram) CUSO4· 5h2Atau di dalam air, seorang kanak -kanak diminta untuk melibatkan plat besi yang digilap. Foto diambil dan prosesnya dibenarkan untuk berkembang selama beberapa minggu.
Pembubaran pada mulanya berwarna kebiruan, tetapi ia akan mula kehilangan pewarnaan sementara plat besi memperoleh warna coppery. Ini kerana tembaga adalah mulia daripada besi, dan oleh itu kationnya cu2+ Mereka akan dikurangkan kepada tembaga logam dari ion yang diberikan oleh pengoksidaan besi:
Fe => Iman2+ + 2e-
Cu2+ + 2e- => Cu
Pembersihan oksida perak
Objek Perak Blackens dari masa ke masa, terutamanya jika mereka bersentuhan dengan sumber sebatian sulfur. Oksidanya boleh dikeluarkan jika objek direndam dalam tab air dengan natrium bikarbonat dan aluminium kerajang. Bikarbonat menyediakan elektrolit yang akan memudahkan pengangkutan elektron antara objek dan aluminium.
Akibatnya, kanak -kanak dapat menghargai objek itu kehilangan bintik -bintik hitam dan akan bersinar dengan warna perak ciri; Sementara kerajang aluminium akan berjalan sehingga hilang.
Rujukan
- Shiver & Atkins. (2008). Kimia bukan organik. (Edisi Keempat). MC Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (8th ed.). Pembelajaran Cengage.
- Wikipedia. (2019). Kakisan galvanik. Diperoleh dari: dalam.Wikipedia.org
- Stephen lebih rendah. (16 Jun, 2019). Kakisan Elektrik. Kimia Librettexts. Pulih dari: chem.Libretxts.org
- Universiti Terbuka. (2018). 2.4 Proses kakisan: kakisan galvanik. Pulih dari: buka.Edu
- Perkhidmatan Teknikal Pelanggan Berus Wellman Inc. (s.F.). Panduan untuk kakisan galvanik. Bahan Kejuruteraan Berus Wellman.
- Giorgio Carboni. (1998). Eksperimen dalam Electremistry. Diperolehi dari: Fensci.com

