Struktur diklorometana, sifat, kegunaan, ketoksikan
- 4952
- 836
- Donnie Ryan
Dia Dichloromethane, Juga dikenali sebagai methylene chloride, ia adalah sebatian organik yang formula kimia adalah ch2Cl2. Khususnya, ia adalah alkil halogenida yang diperolehi daripada gas metana. Tidak seperti metana, sebatian ini adalah cecair tidak berwarna dan kutub.
Ia pada mulanya disintesis pada tahun 1839 oleh ahli kimia dan ahli fizik Perancis Henri Victor Regnault (1810-1878), yang berjaya mengasingkannya dari campuran klorin dan klorometana yang terdedah kepada cahaya matahari.
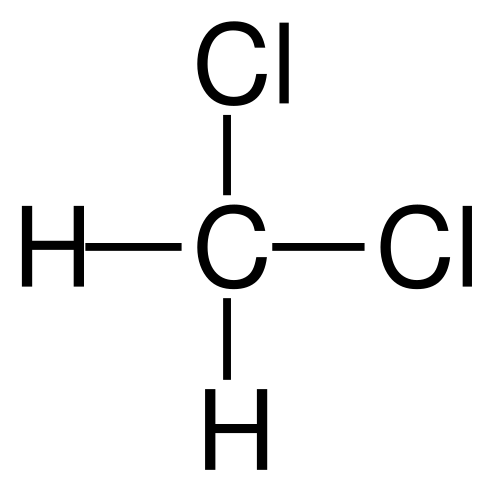 Formula struktur dichloromethane. Sumber: Jü [Domain Awam]
Formula struktur dichloromethane. Sumber: Jü [Domain Awam] Diklorometana berlaku secara industri dengan rawatan metana atau klorometana dengan gas klorin pada suhu tinggi (400-500 ºC). Bersama -sama dengan dichloromethane, ia berlaku dalam proses kloroform dan karbon tetraklorida, yang dipisahkan oleh penyulingan.
Diklorometana digunakan sebagai pelarut yang membolehkan kimpalan bahan plastik dan merendahkan logam. Ia juga digunakan dalam kopi dan teh decaffein.
Diklorometana adalah sebatian toksik yang boleh dihasilkan dengan kerengsaan penyedutan lubang hidung dan tekak. Kerosakan hepatik telah dilaporkan dalam pekerja yang terdedah kepada kepekatan tinggi dichloromethane. Di samping itu, dia adalah ejen mutagenik, yang disyaki sebagai karsinogenik.
[TOC]
Struktur
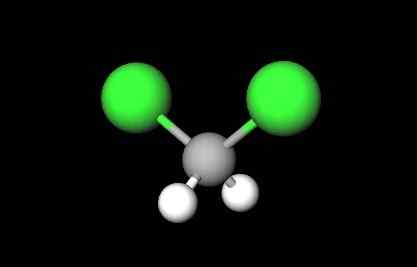
 Struktur molekul diklorometana. Sumber: Gabriel Bolívar melalui Molview.
Struktur molekul diklorometana. Sumber: Gabriel Bolívar melalui Molview. Dalam imej pertama formula struktur CH ditunjukkan2Cl2, di mana ikatan kovalen mereka C-H dan C-CL menonjol. Dan strukturnya diwakili oleh model sfera dan bar. Perhatikan pada pandangan pertama bahawa ikatan C-H (sfera putih) pendek, manakala bon C-CL (sfera hijau) panjang.
Cho Geometry2Cl2 Ia adalah tetrahedral; tetapi diputarbelitkan kerana atom klorin yang paling besar. Satu hujung tetrahedron ditakrifkan oleh dua atom klorin, lebih banyak elektronegatif daripada hidrogen dan karbon. Oleh itu, dalam molekul ch2Cl2 Momen dipole tetap ditubuhkan (1.6d).
Boleh melayani anda: reaksi peneutralanIni membolehkan molekul diklorometana berinteraksi antara satu sama lain melalui pasukan dipole-dipolo. Begitu juga, interaksi intermolecular ini bertanggungjawab untuk kompaun ini wujud sebagai cecair walaupun jisim molekul yang rendah; Cecair yang, bagaimanapun, agak tidak menentu.
Sifat
Penampilan
Cecair tanpa warna.
Jisim molar
84.93 g/mol.
Bau
Manis, serupa dengan kloroform.
Ambang bau
205 - 307 ppm.
Ketumpatan
1,3266 g/cm3 (20 ºC).
Takat lebur
- 97.6 ºC.
Takat didih
39.6 ºC.
Kelarutan air
25.6 g/l pada 15 ºC dan 5.2 g/L A 60 ºC.
Diklorometana hampir tidak larut dalam air. Walaupun kedua -dua molekul, Cho2Cl2 dan h2Atau, mereka adalah kutub, interaksi mereka mungkin tidak cekap kerana penolakan antara atom klorin dan oksigen.
Kelarutan dalam pelarut lain
Dimasukkan dengan etil asetat, alkohol, heksana, benzena, karbon tetraklorida, eter deety, kloroform dan dimethylformamide.
Pekali partisi oktanol/air
Log p = 1.19.
Tekanan wap
57.3 kPa (25 ºC). Tekanan ini sepadan dengan kira -kira 5.66 atm, mencerminkan tekanan stim tinggi.
Ketumpatan stim
2.93 dalam hubungan udara diambil sebagai 1.
Indeks pembiasan (πd)
1,4244 (20 ºC).
Goo
0.413 cp (25 ºC).
titik pencucuhan
Diklorometana tidak mudah terbakar, tetapi apabila dicampur dengan udara, ia membentuk wap mudah terbakar di atas 100 ºC.
Suhu sendiri
556 ºC.
Kestabilan
Ia stabil pada suhu ambien tanpa ketiadaan kelembapan, mempunyai kestabilan relatif apabila dibandingkan dengan congeners: kloroform karbon tetraklorida dan tetrachloride.
Ia cenderung berkarbonat pada suhu tinggi (300-450 ºC), ketika wap mereka bersentuhan dengan klorida keluli dan logam.
Penguraian
Ia boleh dipecahkan kepada permukaan panas atau api, memancarkan wap toksik dan menjengkelkan phosgen dan hidrogen klorida.
Boleh melayani anda: elektron pembezaanKakisan
Diklorometana menyerang beberapa bentuk plastik, karet dan salutan.
Haba pengewapan
28.82 kJ/mol A 25 ºC.
Ketegangan permukaan
28.20 Dynas/cm pada 25 ºC.
Reaktiviti
Diklorometana bertindak balas dengan kuat dengan logam aktif, seperti kalium, natrium dan litium. Bereaksi dengan pangkalan yang kuat, contohnya, kalium Bouthexide. Ia tidak serasi dengan bahan kaustik, oksidan dan logam aktif kimia.
Di samping itu, ia bertindak balas dengan oksigen cecair dalam aloi natrium dan kalium dan nitrogen tetroksida. Hubungan dengan air, anda boleh menjalankan beberapa keluli tahan karat, nikel, tembaga, serta besi.
Aplikasi
Sebilangan besar kegunaan dan aplikasi dichloromethane berdasarkan sifatnya sebagai pelarut. Oleh kerana ciri -ciri ini, diklorometana digunakan dalam makanan, pengangkutan, industri pengeluaran perubatan, dll.
Pemprosesan makanan
Diklorometana digunakan dalam biji kopi dan daun teh tanpa kafein. Ia juga digunakan untuk pengekstrakan hop untuk bir, minuman dan bendera makanan lain, serta untuk pemprosesan rempah.
Industri farmaseutikal
Diklorometana digunakan untuk penyediaan cephalosporin dan ampicillin, sebagai tambahan kepada pembuatan antibiotik, steroid dan vitamin.
Fotografi
Ia juga digunakan sebagai pelarut dalam pengeluaran selulosa triacetate (CTA), yang digunakan dalam penciptaan filem keselamatan.
Industri Elektronik
Ia adalah sebatian yang ideal untuk pengeluaran plat litar bercetak, menggunakan permukaan aluminium sebelum menambahkan fotoret plat.
Cat
Diklorometana adalah pelarut yang terdapat dalam varnis dan pemisah cat, digunakan untuk menghapuskan varnis atau salutan lukisan dari pelbagai jenis permukaan.
Pengangkutan
Ia berfungsi untuk merendahkan bahagian logam dan permukaan yang terdapat dalam peralatan kereta api, serta dalam komponen pesawat.
Boleh melayani anda: air sulingKegunaan lain
Ia digunakan sebagai propelan semburan (aerosol) dan sebagai ejen pengembangan untuk busa poliuretana. Ia juga digunakan sebagai cecair dalam beberapa jenis lampu Krismas.
Ketoksikan
Kesan akut
Penyedutan dichloromethane boleh menyebabkan kerengsaan saluran udara atas, batuk, mengi atau kekurangan udara.
Ia dapat menghasilkan kemerahan kulit, dan jika sebatian itu tetap lama di atasnya, menyebabkan luka bakar kimia. Bersentuhan dengan mata, diklorometana menghasilkan kerengsaan yang teruk yang dapat dibakar.
Di samping itu, ia bertindak sebagai perubahan visual, pendengaran dan psikomotor neurotoksin; Tetapi kesan -kesan ini boleh diterbalikkan untuk menghentikan penyedutan diklorometana.
Kesan kronik
Diklorometana boleh menjejaskan sistem saraf pusat dan menjana sakit kepala, kekeliruan mental, loya, muntah dan kehilangan ingatan.
Pada haiwan ia menghasilkan kesan berbahaya pada hati, buah pinggang, sistem saraf pusat dan sistem kardiovaskular.
Sebaik sahaja karsinogenesis tidak melaporkan peningkatan ketara dalam kematian kanser pada pekerja yang terdedah kepada diklorometana. Walau bagaimanapun, kajian haiwan telah menunjukkan peningkatan yang dikaitkan dengan diklorometana dalam kejadian kanser hati dan paru -paru, serta tumor jinak kelenjar susu.
Rujukan
- Morrison, r. T. dan Boyd, R, n. (1987). Kimia organik. 5TA Edisi. Editorial Addison-Wesley Inter-American.
- Carey f. (2008). Kimia organik. (Edisi keenam). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Kimia organik. (10th Edisi.). Wiley Plus.
- Pusat Kebangsaan Maklumat Bioteknologi. (2020). Dichloromethane. Pangkalan data PUBCHEM., CID = 6344. Pulih dari: pubchem.NCBI.NLM.NIH.Gov
- Wikipedia. (2020). Dichloromethane. Diperoleh dari: dalam.Wikipedia.org
- Brumer. (14 Julai 2018). Dichloromethane. Pulih dari: Brumer.com
- MSDS dalam talian. (2019). Maklumat bahaya & keselamatan dichloromethane (methylene chloride). Diperolehi dari: msdsonline.com
- EPA. (2000). Metilena klorida (diklorometana). [Pdf]. Pulih dari: EPA.Gov

