Reaksi Electrophil, Contoh, Elektrofilik
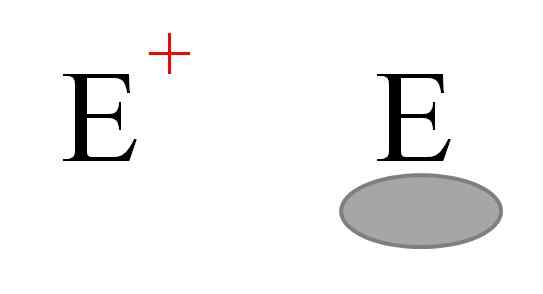
- 3096
- 149
- Anthony Breitenberg
A Electrophil Ini semua spesies kimia (atom atau molekul) yang kelihatan dengan jelas beberapa elektron. Perkataan itu bermaksud 'suka untuk elektron'. Oleh itu, elektrofi akan selalu cenderung untuk memenangi atau menerima elektron ketika mengambil bahagian dalam reaksi kimia.
Apa yang Membuat Elektrofil Memerlukan Elektron? Anda mesti mempunyai kekurangan elektron, sama ada ditunjukkan oleh beban positif atau jumlah positif, atau dengan produk kekosongan elektronik dari oktet valensi yang tidak lengkap. Iaitu, kita mempunyai beberapa jenis elektrofil, walaupun mereka semua menerima pasangan elektron spesies negatif.
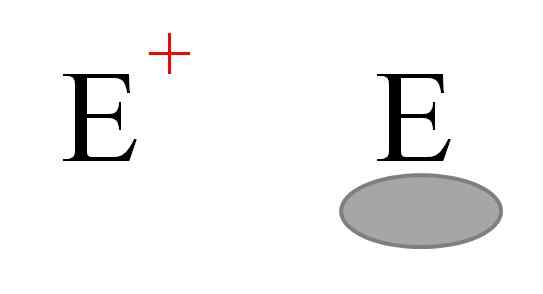 Dua jenis elektrofil yang paling kerap dalam kimia. Sumber: Gabriel Bolívar.
Dua jenis elektrofil yang paling kerap dalam kimia. Sumber: Gabriel Bolívar. Dua jenis elektrofil biasanya diwakili. Kedua -duanya dilambangkan dengan surat dan. Yang di sebelah kiri sepadan dengan elektrofi beban positif, dan+. Sementara itu, yang di sebelah kanan sepadan dengan elektrofil dengan kekosongan elektronik, yang diwakili oleh bujur kelabu yang menunjukkan ketiadaan elektron dalam orbital Valencia.
Kation logam adalah contoh elektrofil dan+, Serta beberapa ion polyiatomik seperti hidronium, h3Sama ada+. Molekul Alh3 dan bf3, Sebaliknya, mereka adalah contoh jenis elektrofil kedua, kerana kedua -dua atom aluminium dan boron mempunyai kekurangan elektron kerana mereka tidak melengkapkan oktet Valencia.
[TOC]
Reaksi
Elektrofil bertindak balas menerima pasangan elektron atom dengan kepadatan negatif yang tinggi, iaitu, elektron kaya. Atom atau molekul negatif ini dipanggil nukleofil, NU-, yang mendermakan beberapa elektron ke elektrofi dan e e+:
Wildebeest- + Dan+ → Nu-e
Ini adalah asas teoritis untuk banyak tindak balas organik, seperti penggantian elektrofilik aromatik. Nukleofil tidak semestinya harus menjadi anion, tetapi ia juga boleh menjadi molekul neutral dengan atom elektronegatif, seperti nitrogen.
Boleh melayani anda: silikon: sejarah, sifat, struktur, mendapatkan, kegunaanContoh elektrofil
Asid Lewis
Asid Lewis adalah elektrofil, kerana dengan definisi mereka menerima pasangan elektron. Kation logam, mn+, menarik kawasan negatif molekul kutub sekitar dalam proses solvation. Oleh itu, mn+ berakhir di sekeliling beban negatif, bahkan datang untuk menerima elektron untuk membentuk kompleks koordinasi.
CUCION CU2+, Sebagai contoh, ia adalah asid Lewis dan elektrofil kerana ia diselaraskan dengan atom oksigen air untuk membentuk ACU kompleks2)62+. Dengan cara yang sama ia berlaku dengan kation lain.
Tidak semua asid Lewis adalah kation: ada yang molekul atau atom neutral. Sebagai contoh, bf3 Ia adalah asid lewis dan elektrofil kerana.
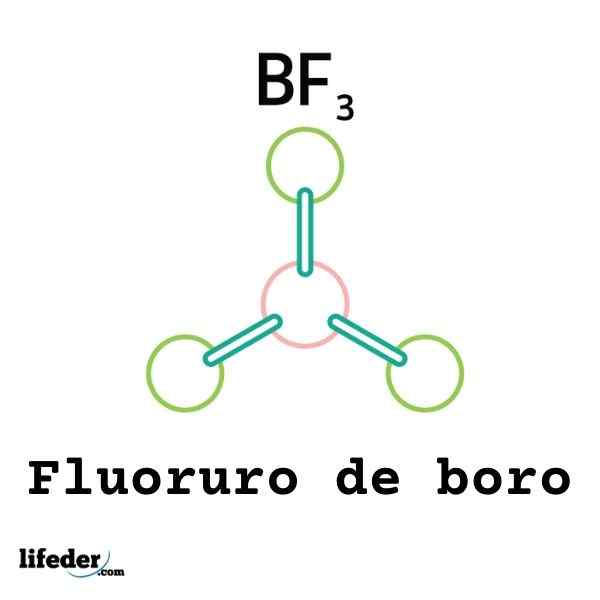
Oleh itu, ia akan dikaitkan dengan anion fluorida di sekeliling untuk membentuk anion boro tetrafluoruro, bf4-. Iaitu bf3 membentuk pautan dengan f- dengan menerima beberapa elektron mereka.
Elektrofi lain adalah ion Nitronio, tidak2+, yang merupakan Ejen Elektrofil sangat kuat terbentuk dalam tindak balas nitrasi benzena. Dalam ion itu atom nitrogen mempunyai beban positif, jadi elektron benzena dengan cepat menerima.
Asid Brönsted
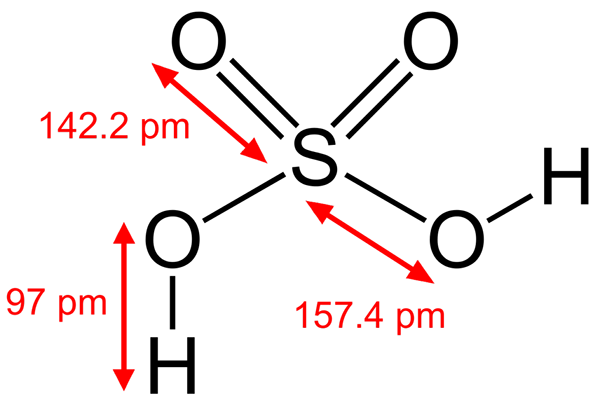 Struktur asid sulfurik
Struktur asid sulfurik Beberapa asid Brönsted juga elektrofil. Sebagai contoh, kation hidronium, h3Sama ada+, Ia adalah elektrofil kerana atom oksigen mempunyai beban positif. Menjadi sangat elektronegatif, anda akan berusaha mendapatkan elektron yang mendermakan salah satu hidrogennya untuk berubah menjadi molekul air.
Satu lagi asid brönsted seperti asid sulfurik, h2SW4, Ia juga elektrofil. Atom sulfur sangat teroksida, dan akan berusaha mendapatkan elektron yang mendermakan dua hidrogennya.
Boleh melayani anda: Karbon Tetrachloride (CCL4)Halogen
Halogen (f2, Cl2, Br2 dan saya2) Mereka adalah elektrofil. Atomnya tidak mempunyai kekurangan elektronik; Walau bagaimanapun, pautan mereka tidak stabil, kerana kedua-dua atom, x-x, sangat menarik elektron kepada mereka.
Oleh itu, halogen bertindak balas sebagai agen pengoksidaan, berkelakuan sebagai elektrofil dan menerima pasangan elektron menjadi anion halogenida (f-, Cl-, Br- dan saya-).
Walau bagaimanapun, halogen bukan sahaja memenangi elektron dengan cara ini. Mereka juga boleh dikaitkan dengan atom elektronegatif yang kurang daripada mereka untuk mendapatkan keuntungan elektron bersih. Sebagai contoh, inilah sebabnya mengapa mereka boleh ditambah kepada ikatan ganda alkena atau olefin.
Halogen mewakili jenis elektrofi yang berbeza kepada kedua -dua yang diperkenalkan pada awalnya. Walau bagaimanapun, tingkah lakunya pada akhirnya adalah sama seperti untuk semua elektrofil: terima pasangan elektron.
Sewa dan hidrogen halida
 Molekul CFC adalah alkil halida
Molekul CFC adalah alkil halida Sewa dan hidrogen halida adalah elektrofil di mana atom yang dipautkan halogen mempunyai kekurangan elektronik yang kuat yang diwakili oleh simbol δ+. Ini kerana halogen, sangat elektronegatif, menarik ketumpatan elektronik atom jiran dengan sendirinya.
Untuk alkil halida, rx, r akan mempunyai kekurangan elektronik manakala x berlebihan elektron, r, rδ+-Xδ-. Oleh itu, jika spesies yang sangat negatif mendekati Rx, ia akan menyerang R untuk menghubungkannya dan membuat X keluar sebagai anion.
Juga, dalam hidrogen halida, HX, hidrogen mempunyai kekurangan elektronik atau beban separa positif, Hδ+-Xδ-. Oleh itu, spesies negatif akan menghasilkan elektron mereka kepada hidrogen ini dan dia, sebagai elektrofil, akan menerima mereka.
Sebatian Carbonyl
Asid, halogen dan halida bukan satu -satunya molekul yang boleh diklasifikasikan sebagai elektrofil. Walaupun tidak, Karbon Dioksida, CO2, Ia adalah elektrofil, kerana atom karbon pusat sangat teroksida, atau = cδ+= O.
Boleh melayani anda: kelalang latar belakang rataOleh itu, ketika bersama -2 Reacta akan melakukannya menerima pasangan elektron, sama ada menjadi karboksilat, kumpulan COOH, atau anion karbonat, co32-.
Sebagai tambahan kepada CO2, Sebatian karbonyl, seperti keton, aldehid dan ester juga merupakan contoh elektrofil, kerana di dalamnya karbon mempunyai beban separa positif dan cenderung menerima elektron spesies yang sangat negatif.
Carbocations
 Atom karbon metana dimuat secara positif
Atom karbon metana dimuat secara positif Carbocations sangat kuat asid Lewis. Terdapat Tertiary (r3C+), menengah (r2HC+) atau utama (rh2C+). Karbon selalu membentuk empat ikatan, jadi kation ini khususnya akan mencari cara untuk menerima elektron dengan cara apa pun.
Electrophilicity
Tidak semua elektrofil sama seperti "lapar" oleh elektron. Ada yang lebih reaktif daripada yang lain. Semakin besar kekurangan elektrofil elektronik, semakin besar kepekaannya untuk mengalami serangan nukleofilik spesies negatif. Iaitu, ia akan membentangkan elektrofiliti yang lebih besar, yang merupakan ukuran relatif bagaimana reaktif adalah elektrofil yang dipersoalkan.
Sebagai contoh, karbokati, nitronium dan fluorida mempunyai elektrofila yang tinggi; Walaupun karbon dioksida atau beberapa kation seperti natrium mempunyai elektrofilasi yang rendah.
Rujukan
- Shiver & Atkins. (2008). Kimia bukan organik. (Edisi Keempat). MC Graw Hill.
- Morrison, r. T. dan Boyd, R, n. (1987). Kimia organik. Edisi ke -5. Editorial Addison-Wesley Inter-American.
- Carey f. (2008). Kimia organik. (Edisi keenam). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Kimia organik. (Edisi ke -10.). Wiley Plus.
- Wikipedia. (2020). Elektrofil. Diperoleh dari: dalam.Wikipedia.org
- James Ashenhurst. (2020). Nukleofil dan elektrofil. Pulih dari: masterorganicchemistry.com
- Profesor Patricia Shaley. (2012). Nukleofil dan elektrofil. Universiti Illinois. Pulih dari: butana.Chem.Uiuc.Edu
- Danielle Reid. (2020). Electrophile: Definisi & Contohnya. Kajian. Pulih dari: belajar.com
- Tim Soderberg. (7 Oktober 2019). Elektrofil. Kimia Librettexts. Pulih dari: chem.Libretxts.org
- « Formula Undang-undang Biot-Savart, Demonstrasi, Aplikasi, Latihan
- Undang -undang Toleransi Shelford Apa yang terdiri dan contohnya »

