Elektron pembezaan

- 1284
- 103
- Anthony Breitenberg
Dia elektron pembezaan o Pembezaan adalah elektron terakhir yang diletakkan dalam urutan konfigurasi elektronik atom. Siapa nama anda? Untuk menjawab soalan ini, perlu mengetahui struktur asas atom: nukleus, kekosongan dan elektron.
Nukleus adalah agregat padat dan padat zarah positif yang dipanggil proton, dan zarah neutral yang disebut neutron. Proton menentukan nombor atom z dan, bersama -sama dengan neutron, membentuk jisim atom. Walau bagaimanapun, atom tidak boleh membawa hanya caj positif; Oleh itu elektron mengorbit di sekitar nukleus untuk meneutralkannya.
 Struktur atom asas: zarah subatom utama
Struktur atom asas: zarah subatom utama Oleh itu, bagi setiap proton yang menambah nukleus, elektron baru dimasukkan ke dalam orbitalnya untuk mengatasi caj positif yang semakin meningkat. Dengan cara ini, elektron tambahan baru, elektron pembezaan, berkait rapat dengan nombor atom z.
Elektron pembezaan terdapat di lapisan elektronik paling luar: lapisan Valencia. Oleh itu, nukleus selanjutnya, semakin besar tenaga yang berkaitan dengannya. Tenaga ini bertanggungjawab untuk penyertaannya, dan juga dari seluruh elektron Valencia, dalam reaksi kimia ciri unsur -unsur.
[TOC]
Nombor kuantum
Serta selebihnya elektron, elektron pembezaan dapat dikenal pasti dengan empat nombor kuantumnya. Tetapi apakah nombor kuantum? Mereka adalah "n", "l", "m" dan "s".
Nombor kuantum "N" menandakan saiz atom dan tahap tenaga (K, L, M, N, atau, P, Q). "L" adalah nombor kuantum menengah atau acemutal, yang menunjukkan bentuk orbital atom, dan mengambil nilai 0, 1, 2 dan 3 untuk orbital "s", "p", "d" dan "f ", masing -masing.
Ia boleh melayani anda: Flask Aphorated: Ciri -ciri, Apa itu, Jenis, Kegunaan"M" adalah nombor kuantum magnet dan menunjukkan orientasi ruang orbital di bawah medan magnet. Oleh itu, 0 untuk orbital "s"; -1, 0, +1, untuk orbital "P"; -2, -1, 0, +1, +2, untuk orbital "d"; dan -3, -2, -1, 0, +1, +2, +3, untuk orbital "F". Akhirnya, bilangan kuantum spin "s" (+1/2 untuk ↑, dan -1/2 untuk ↓).
Oleh itu, elektron pembezaan telah mengaitkan nombor kuantum sebelumnya ("n", "l", "m", "s"). Kerana ia mengatasi beban positif baru yang dihasilkan oleh proton tambahan, ia juga menyediakan nombor atom z dari elemen.
Bagaimana mengetahui elektron pembezaan?
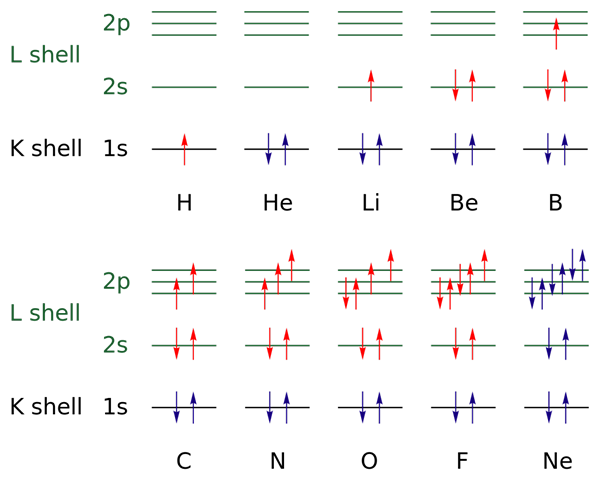
Dalam imej atas, konfigurasi elektronik diwakili untuk unsur -unsur dari hidrogen hingga gas neon (H → NE).
Dalam hal ini, elektron lapisan terbuka ditunjukkan dengan warna merah, manakala lapisan tertutup ditunjukkan dengan warna biru. Lapisan merujuk kepada nombor kuantum "n", yang pertama dari empat.
Dengan cara ini, konfigurasi Valencia H (↑ of Red) menambah elektron lain dengan orientasi yang bertentangan untuk menjadi HE (↓ ↑, kedua -dua biru kerana sekarang tahap 1 ditutup). Elektron tambahan ini kemudiannya elektron pembezaan.
Oleh itu, dapat diperhatikan bagaimana elektron pembezaan menambah lapisan valensi (anak panah merah) dari unsur -unsur, membezakannya dari satu sama lain. Elektron mengisi orbital yang menghormati peraturan sinki dan prinsip pengecualian Pauling (diperhatikan dengan sempurna dari B ke NE).
Dan bagaimana dengan nombor kuantum? Ini menentukan setiap anak panah - ia.
Ia dapat melayani anda: apakah kesan negatif yang kita ada dengan kelarutan air?Contoh elektron pembezaan dalam beberapa elemen
Klorin
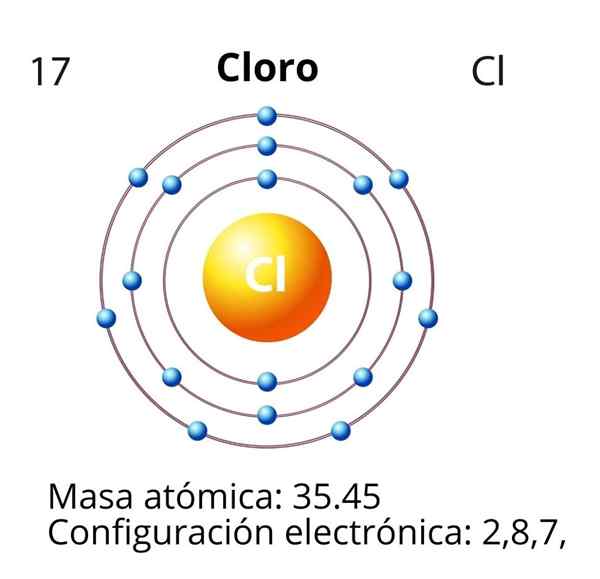
Dalam kes klorin (cl) nombor atomnya z adalah sama dengan 17. Konfigurasi elektronik kemudian 1s22s2sp63s23p5. Orbital yang ditandai dengan warna merah sesuai dengan lapisan Valencia, yang membentangkan Tahap 3 Terbuka.
Elektron pembezaan adalah elektron terakhir yang diletakkan dalam konfigurasi elektronik, dan atom klorin adalah orbital 3p, yang pelupusannya adalah seperti berikut:
↑ ↓ ↑ ↓ ↑ _
3px 3py 3pz
(-1) (0) (+1)
Menghormati peraturan sink, orbital 3p pertama kali dipenuhi dengan tenaga yang sama (anak panah menaik di setiap orbital). Kedua, pasangan elektron lain dengan kesepian kiri ke kanan elektron. Elektron pembezaan diwakili dalam bingkai hijau.
Oleh itu, elektron pembezaan untuk klorin mempunyai nombor kuantum berikut: (3, 1, 0, -1/2). Iaitu, "n" adalah 3; "L" adalah 1, orbital "p"; "M" adalah 0, kerana ia adalah orbital "P" medium; Dan "s" adalah -1/2, kerana anak panah menunjuk ke bawah.
Magnesium
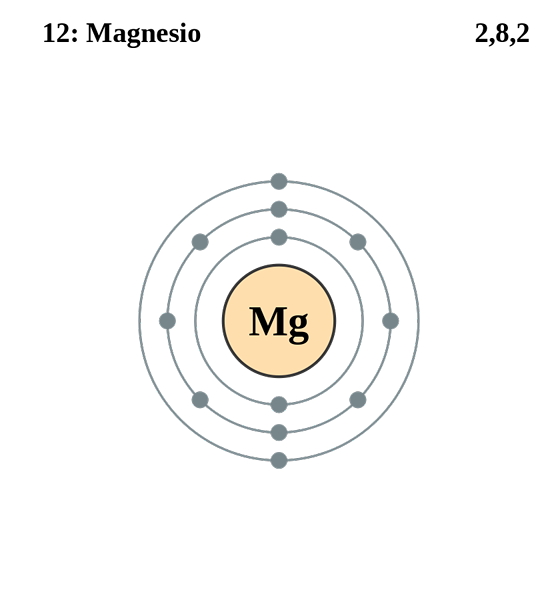 Konfigurasi magnesium elektronik. Sumber: electron_shell_012_magnesium.SVG: Pumbaa (karya asal oleh Greg Robson) Kerja Derivatif: Kizar, CC By-SA 3.0, melalui Wikimedia Commons
Konfigurasi magnesium elektronik. Sumber: electron_shell_012_magnesium.SVG: Pumbaa (karya asal oleh Greg Robson) Kerja Derivatif: Kizar, CC By-SA 3.0, melalui Wikimedia Commons Konfigurasi elektronik untuk atom magnesium adalah 1s22s2sp63s2, Mewakili Orbital dan Elektron Valencia dengan cara yang sama:
↑ ↓
3s
0
Kali ini, elektron pembezaan mempunyai nombor kuantum 3, 0, 0, -1/2. Satu -satunya perbezaan dalam kes ini berkenaan dengan klorin adalah bahawa nombor kuantum "l" adalah 0 kerana elektron menduduki orbital "s" (3s).
Zirkonio
Konfigurasi elektronik untuk atom zirkonium (logam peralihan) adalah 1s22s2sp63s23p64s23d104p65s24d2. Dengan cara yang sama bahawa kes -kes sebelumnya, perwakilan orbital dan elektron Valencia adalah seperti berikut:
Ia boleh melayani anda: Cyclopentano (C5H10): Struktur, sifat dan kegunaan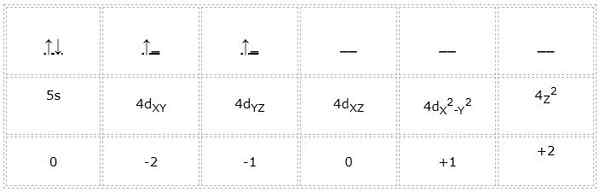
Oleh itu, nombor kuantum untuk elektron pembezaan yang ditandai dengan hijau ialah: 4, 2, -1, +1/2. Di sini, kerana elektron menduduki orbital kedua "d", ia mempunyai nombor kuantum "m" sama dengan -1. Juga, kerana anak panah menunjuk, nombor putarannya "s" sama dengan +1/2.
Elemen yang tidak diketahui
Nombor kuantum elektron pembezaan untuk elemen yang tidak diketahui ialah 3, 2, +2, -1/2. Apakah nombor atom z dari elemen? Mengetahui Z dapat menguraikan unsur itu.
Kali ini, sebagai "n" adalah sama 3, ini bermakna elemen itu dalam tempoh ketiga jadual berkala, dengan orbital "d" sebagai lapisan Valencia ("l" sama dengan 2). Oleh itu, orbital diwakili seperti dalam contoh sebelumnya:
↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓
Nombor kuantum "m" sama dengan +2, dan "s" sama dengan -1/2, adalah kunci untuk mencari elektron pembezaan dengan betul dalam orbital 3D terakhir.
Oleh itu, elemen yang dicari mempunyai orbital 3D10 penuh, seperti lapisan elektronik dalamannya. Kesimpulannya, elemen adalah zink logam (Zn).
Walau bagaimanapun, bilangan kuantum elektron pembezaan tidak dapat membezakan antara zink dan tembaga, kerana elemen terakhir ini juga membentangkan orbital 3D penuh. Kerana? Kerana tembaga adalah logam yang gagal dengan peraturan yang dipenuhi dengan elektron atas alasan kuantum.
Rujukan
- Jim Branson. (2013). Peraturan tenggelam. Diperolehi daripada Quantummechanics.UCSD.Edu
- Kuliah 27: Peraturan Tenggelam. Pulih dari pH.Qmul.Ac.UK
- Universiti Purdue. Nombor kuantum dan konfigurasi elektron. Diperolehi daripada Murmed.Chem.Purdue.Edu
- Salvat Encyclopedia of Science. (1968). Fizik Salvat, s.Ke. Edisi Pamplona, Jilid 12, Sepanyol, ms 314-322.
- Walter J. Moore. (1963). Kimia Fizikal. Dalam Zarah dan gelombang. Edisi keempat, Longmans.

