Konsep elektrolit yang kuat, ciri, contoh

- 3716
- 148
- Ms. Edgar Carroll
A Elektrolit yang kuat Ini semua bahan yang dibubarkan di dalam air, atau dalam pelarut tertentu, sepenuhnya dipisahkan pada ion. Oleh itu, tidak sepatutnya menjadi penyelesaian sebagai molekul neutral, atau sebagai pepejal yang tidak larut. Elektrolit yang kuat boleh menjadi garam, asid atau asas, dengan syarat mereka memisahkan atau sepenuhnya ionik.
Contoh yang paling mewakili elektrolit adalah garam biasa, natrium klorida, NaCl. Dalam larutan akueus, kristal NaCl memisahkan keseluruhannya untuk menghasilkan ion na+ dan Cl-, yang berakhir dengan molekul air sekitar. Kemudian dikatakan bahawa garam berkelakuan seperti elektrolit yang kuat apabila kelarutannya sangat tinggi di dalam air.
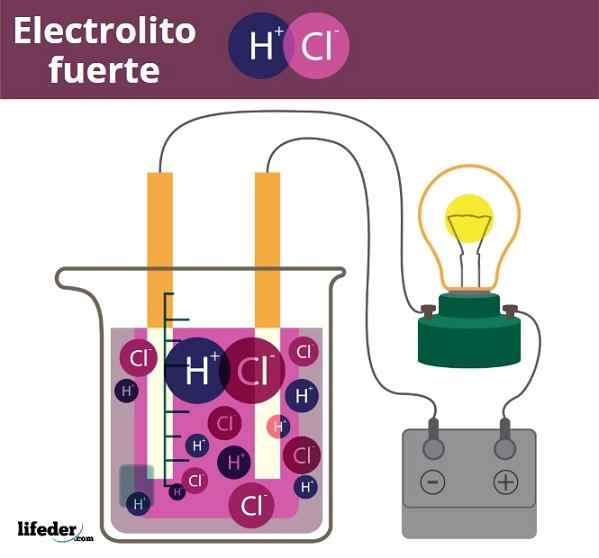 Contoh elektrolit Fuero. HCL, asid hidroklorik, melepaskan H3O+ dan ion Cl-
Contoh elektrolit Fuero. HCL, asid hidroklorik, melepaskan H3O+ dan ion Cl- Agak serupa adalah kes asid dan pangkalan. Apabila ini kuat, penyelesaiannya dalam air menghasilkan jumlah maksimum yang mungkin berlaku3Sama ada+ atau oh-, Jadi perubahan pH tiba -tiba. Contoh asid dan asas yang kuat adalah asid nitrik, HNO3, dan kalium hidroksida, KOH, masing -masing.
Adalah penting untuk mengetahui cara mengenal pasti elektrolit yang kuat semasa menyediakan penyelesaian yang sangat ionik, atau asid yang sangat kuat atau cara asas.
[TOC]
Ciri -ciri elektrolit yang kuat
Kelarutan
Elektrolit yang kuat dicirikan dengan menjadi bahan air yang sangat larut. Sama ada pepejal atau gas, apabila bersentuhan dengan air, ia tidak boleh ditangguhkan terlalu banyak untuk dibubarkan sepenuhnya. Sekiranya garam, sebagai contoh, sedikit larut dalam air, boleh dibuang sebagai elektrolit yang kuat.
Kekonduksian ionik
Elektrolit yang kuat tidak hanya larut dalam air, tetapi juga menghasilkan sebilangan besar ion. Terima kasih kepada caj elektrik ion -ion ini, elektron dapat dengan selesa mengembara penyelesaiannya. Ini ditunjukkan dalam peningkatan kekonduksian ionik berkenaan dengan air tulen. Itulah sebabnya penyelesaian ionik memimpin elektrik yang sangat baik.
Boleh melayani anda: klorin: sejarah, sifat, struktur, risiko, kegunaanNeutraliti Saline
Ramai elektrolit yang kuat, apabila melarutkan air, jangan menghasilkan perubahan pH. Ini bermakna penyelesaian garam ini tidak berasid atau asas, tetapi neutral, dengan pH hampir 7.
Walau bagaimanapun, mungkin ada asid atau garam asas yang mudah dibubarkan di dalam air, dan juga menghasilkan ion lengkap. Contohnya, natrium karbonat2Co3, larut untuk menjana ion na+ dan co32-, Tetapi pH penyelesaiannya adalah asas.
Contoh elektrolit yang kuat
 Natrium klorida adalah contoh yang paling mewakili elektrolit yang kuat. Sumber: Cristian V. /CC BY-SA (https: // creativeCommons.Org/lesen/by-sa/4.0)
Natrium klorida adalah contoh yang paling mewakili elektrolit yang kuat. Sumber: Cristian V. /CC BY-SA (https: // creativeCommons.Org/lesen/by-sa/4.0) Elektrolit yang kuat, yang begitu banyak, dibahagikan kepada tiga klasifikasi: asid kuat, pangkalan yang kuat, dan produk garam larut dalam neutralizations antara dua yang pertama.
Asid kuat
Asid kuat apabila melarutkan air, tanpa sebarang masalah, mesti menghasilkan jumlah maksimum h3Sama ada+, Jadi asid mesti sepenuhnya ion; iaitu, ia tidak sepatutnya wujud sebagai molekul neutral dengan proton asid tanpa melepaskan.
Contoh asid ini adalah:
-HCL, asid hidroklorik, melepaskan H ion3Sama ada+ dan Cl-
-HF, asid fluorhoric, melepaskan H ion3Sama ada+ dan f-
-Hno3, Asid nitrik, lepaskan hones h3Sama ada+ dan tidak3-
-Hclo4, asid percloric, melepaskan h ion3Sama ada+ dan clo4-
-Hio4, asid periódic, mengeluarkan ion h3Sama ada+ dan io4-
-H2SW4, asid sulfurik, lepaskan hones h3Sama ada+ Dan juga42-
Sebab mengapa ion hidrium, h3Sama ada+, Ia sentiasa hadir (satu cara atau yang lain), kerana hidrogen yang mereka sumbangkan diterima oleh molekul air:
HCL + H2O → h3Sama ada+ + Cl-
Tindak balasnya langsung dan tidak dapat dipulihkan. Ini adalah ciri asid yang kuat, yang seterusnya adalah elektrolit yang kuat kerana pengionan penuhnya di dalam air.
Boleh melayani anda: hidrokarbon alifatik: sifat, tatanama, reaksi, jenisPangkalan yang kuat
Pangkalan yang kuat, larut dalam air tanpa sebarang masalah, mesti melepaskan ion oh- dari kristal yang sama, atau tidak dapat dipulihkan molekul air untuk menghasilkannya.
Banyak pangkalan yang kuat terdiri daripada pepejal ion dan bukan molekular. Beberapa contoh pangkalan ini yang berkelakuan sebagai elektrolit yang kuat adalah:
-Lioh, lithium hidroksida, mengeluarkan oh ion- dan li+
-NaOH, Natrium Hidroksida, Melancarkan OH Ion- dan na+
-RBOH, Rubidio Hydroxide, mengeluarkan oh ion- dan rb+
-CA (oh)2, kalsium hidroksida, melepaskan ion oh- dan ca2+
-Sr (oh)2, Strontium hidroksida, melepaskan oh ion- dan Encik2+
-BA (oh)2, barium hidroksida, melepaskan oh ion- dan ba2+
-Nah, natrium hidrida, mengeluarkan oh ion- dan gas hidrogen, h2
-Nanh2, Natrium Amiduro, melepaskan ion oh- dan gas ammonia, NH3
Awak keluar
HALLOBASI Kuat Elektrolit Ketika Larutan Di dalam Air Mesti Dibuat sepenuhnya. Ramai di antara mereka tidak menghasilkan perubahan pH. Ini kerana ion mereka sangat stabil, jadi mereka tidak mengambil bahagian dalam baki hidrolisis untuk mengubah sifat air. Contoh garam ini adalah:
-NaCl, natrium klorida, melepaskan ion na+ dan Cl-
-Agno3, Nitrat perak, pelepasan ion+ dan tidak3-
-Abang3, natrium nitrat, melepaskan ion+ dan tidak3-
-K2SW4, kalium sulfat, melepaskan k ion+ Dan juga42-
-Mgcl2, Magnesium klorida, melepaskan ion mg2+ dan Cl-
-Cuso4, Cupric sulfate, melepaskan ion cu2+ Dan juga42-
-KBR, Potassium Bromide, melepaskan K ion+ dan br-
-NH4CL, ammonium klorida, mengeluarkan ion NH4+, Cl-, H3Sama ada+ dan gas ammonia
Ia boleh melayani anda: Mercury Chloride (ii): Struktur, sifat, mendapatkan, menggunakan-NACN, Natrium Cyanide, mengeluarkan ion NA+ dan CN-
-Na3PO4, natrium fosfat, mengeluarkan ion na+ dan po43-
-CRCL3, Kromik klorida, melepaskan cr ion3+ dan Cl-
-Aub3, Auric Bromide, mengeluarkan ion au3+ dan br-
-Snso4, Estany Sulfate, mengeluarkan ion sn2+ Dan juga42-
NH4CL adalah contoh yang bercanggah: ia benar -benar terionisasi, tetapi pada masa yang sama ia menghasilkan molekul neutral ammonia kerana ia adalah garam asid.
Perbezaan antara elektrolit yang kuat dan lemah
Walaupun perbezaan antara elektrolit yang kuat yang lemah telah ditubuhkan secara tidak langsung, ini akan dibentangkan di bawah sebagai kesimpulan:
-Elektrolit yang kuat sangat larut di perairan; Elektrolit lemah tidak.
-Pengionan elektrolit yang lemah adalah sebahagian, yang bermaksud bahawa mungkin ada molekul neutral dalam larutan. Sebaliknya, elektrolit yang kuat wujud secara eksklusif sebagai ion.
-Asid dan asas yang lemah, yang seterusnya adalah elektrolit yang lemah, tidak memisahkan diri sepenuhnya di dalam air, jadi mereka menghasilkan kurang ion h3Sama ada+ atau oh- Apa yang boleh dijangkakan.
-Halth -Halin Electrolytes kuat hampir tidak dihidrolisiskan berbanding dengan elektrolit yang lemah. Oleh itu, penyelesaian bekas cenderung neutral, kecuali apabila mereka berurusan dengan asid atau garam asas.
Rujukan
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (8th ed.). Pembelajaran Cengage.
- Shiver & Atkins. (2008). Kimia bukan organik. (Edisi Keempat). MC Graw Hill.
- Wikipedia. (2020). Elektrolit yang kuat. Diperoleh dari: dalam.Wikipedia.org
- Helmestine, Anne Marie, Ph.D. (11 Februari 2020). Definisi dan contoh elektrolit yang kuat. Pulih dari: Thoughtco.com
- Chung & Chieh. (5 Jun, 2019). Elektrolit. Kimia Librettexts. Pulih dari: chem.Libretxts.org

