Elektronegativiti
- 761
- 48
- Donnie Ryan
Apakah elektronegativiti?
The Elektronegativiti Ini adalah harta berkala relatif yang menyangkut keupayaan atom menarik ketumpatan elektronik persekitaran molekulnya. Ini adalah trend atom untuk menarik elektron ke arah dirinya apabila ia dilampirkan pada molekul. Ini ditunjukkan dalam tingkah laku banyak sebatian dan bagaimana intermolecularly berinteraksi antara satu sama lain.
Dalam erti kata lain, lebih banyak elektronegatif ia adalah atom, semakin besar keupayaan untuk menarik elektron atom lain; Ia juga akan mempunyai potensi pengionan yang lebih tinggi, yang membolehkan anda mengekalkan elektron anda dalam menghadapi tarikan luaran sambil menarik elektron atom sekitarnya.
Sekarang, tidak semua elemen menarik elektron atom bersebelahan dengan tahap yang sama. Sekiranya mereka yang menghasilkan ketumpatan elektronik, dikatakan bahawa mereka adalah Electropositive, Manakala mereka yang "menutup" elektron adalah elektronegatif. Terdapat banyak cara untuk menerangkan dan memerhatikan harta ini (atau konsep).
Sebagai contoh, dalam peta potensi elektrostatik untuk molekul (seperti klorin dioksida imej unggul, CLO2) Kesan elektronegativiti yang berbeza untuk atom klorin dan oksigen diperhatikan.
Warna merah menunjukkan kawasan yang kaya dengan elektron molekul, δ-, dan warna biru yang miskin elektron, δ+. Oleh itu, selepas satu siri pengiraan pengiraan jenis peta ini dapat diwujudkan; Ramai di antara mereka menunjukkan hubungan langsung antara lokasi atom elektronegatif dan δ-.
Ia juga boleh divisualisasikan seperti berikut: Dalam molekul, lebih mungkin bahawa transit elektron berlaku di sekitar atom elektronegatif yang paling.
Oleh sebab itu, untuk CLO2 Atom oksigen (sfera merah) dikelilingi oleh awan merah, manakala atom klorin (sfera hijau) awan kebiruan.
Takrif elektronegativiti bergantung kepada pendekatan yang diberikan kepada fenomena, terdapat beberapa skala yang menganggapnya dari pelbagai aspek. Walau bagaimanapun, semua skala mempunyai persamaan bahawa ia disokong oleh sifat atom intrinsik.
Skala elektronegativiti
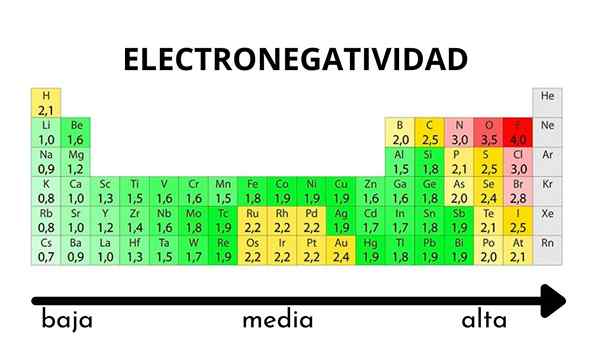
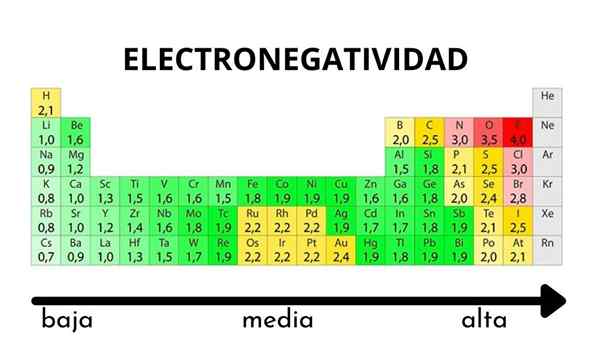 Dalam jadual berkala, ia dapat diperhatikan apabila nilai elektronegativiti meningkat atau berkurangan
Dalam jadual berkala, ia dapat diperhatikan apabila nilai elektronegativiti meningkat atau berkurangan Elektronegativiti bukan harta yang boleh diukur dan tidak mempunyai nilai mutlak. Ini kerana trend atom menarik ketumpatan elektronik ke arahnya tidak sama dalam semua sebatian. Dengan kata lain: Elektronegativiti berbeza -beza bergantung kepada molekul.
Sekiranya untuk molekul CLO2 Atom CL akan ditukar kepada N, maka kecenderungan atau menarik elektron juga akan diubah suai; Ia dapat ditingkatkan (dapatkan awan merah) atau penurunan (kehilangan warna). Perbezaannya akan terletak pada pautan N-O baru yang dibentuk, untuk mempunyai molekul O-N-O (nitrogen dioksida, tidak2).
Ia dapat melayani anda: hubungan kimia dan teknologi dengan manusia, kesihatan dan persekitaranOleh kerana elektronegativiti atom tidak sama untuk semua persekitaran molekulnya, adalah perlu untuk menentukannya mengikut pembolehubah lain. Dengan cara ini, terdapat nilai -nilai yang berfungsi sebagai rujukan dan yang membolehkan meramalkan, contohnya, jenis pautan yang terbentuk (ionik atau kovalen).
Skala Pauling
Saintis hebat dan pemenang dua Anugerah Nobel, Linus Pauling (1901-1994), yang dibangkitkan pada tahun 1932 bentuk elektronegativiti kuantitatif (diukur), yang dikenali sebagai skala Pauling. Di dalamnya, elektronegativiti dua elemen, A dan B, membentuk pautan, berkaitan dengan tenaga tambahan yang berkaitan dengan watak ionik pautan A-B.
Secara teorinya ikatan kovalen adalah yang paling stabil, kerana pengedaran elektron mereka antara dua atom adalah saksama; iaitu, untuk molekul A-A dan B-B kedua-dua atom berkongsi elektron ikatan dengan cara yang sama. Walau bagaimanapun, jika A adalah lebih elektronegatif, maka pasangan berkata akan lebih daripada b.
Dalam hal ini, A-B tidak lagi kovalen sepenuhnya, walaupun jika elektronegativiti tidak banyak, dapat dikatakan bahwa pautannya mempunyai watak kovalen yang tinggi. Apabila ini berlaku, pautan mengalami ketidakstabilan kecil dan memperoleh tenaga tambahan sebagai hasil daripada perbezaan elektronegativiti antara a dan b.
Semakin besar perbezaan ini, semakin banyak tenaga pautan A-B, dan akibatnya, semakin besar watak ionik pautan tersebut.
Skala ini mewakili yang paling banyak digunakan dalam kimia, dan nilai elektronegativiti muncul dari peruntukan nilai 4 untuk atom fluorin (elemen dengan elektronegativiti terendah adalah cessium, dengan 0.7). Dari situ mereka dapat mengira unsur -unsur lain.
Skala Mulliken
Walaupun skala Pauling mempunyai kaitan dengan tenaga yang berkaitan dengan pautan, skala Robert Mulliken (1896-1986) lebih berkaitan dengan dua sifat berkala yang lain: tenaga pengionan (EI) dan pertalian elektronik (AE).
Oleh itu, elemen dengan nilai tinggi EI dan AE sangat elektronegatif, dan oleh itu, ia akan menarik elektron dari persekitaran molekulnya.
Kerana? Kerana ia mencerminkan betapa sukarnya untuk "memulakan" elektron luaran, dan betapa stabil anion yang terbentuk dalam fasa gas sangat stabil. Jika kedua -dua sifat mempunyai magnitud yang tinggi, maka elemen itu adalah "kekasih" elektron.
Boleh melayani anda: gabunganElektronegativiti Mulliken dikira dengan formula berikut:
ΧM = ½ (ei + ae)
Iaitu, χM Ia sama dengan nilai purata EI dan AE.
Walau bagaimanapun, tidak seperti skala Pauling yang bergantung kepada apa yang membentuk atom, ini berkaitan dengan sifat -sifat keadaan Valencia (dengan konfigurasi elektronik yang paling stabil).
Kedua -dua skala menghasilkan nilai elektronegativiti yang serupa untuk unsur -unsur dan berkaitan dengan penukaran berikut:
ΧP = 1.35 (χM)1/2 - 1.37
Kedua -dua xM sebagai xP Mereka adalah nilai tanpa dimensi; iaitu, mereka kekurangan unit.
Skala a.L. Allred dan e. Rochow
Terdapat skala lain elektronegativiti, seperti Sanderson dan Allen. Walau bagaimanapun, yang mengikuti dua yang pertama adalah skala Allred dan Rochow (χAr). Skala ini didasarkan pada beban nuklear yang berkesan yang pengalaman elektron di permukaan atom. Oleh itu, ia secara langsung berkaitan dengan daya menarik nukleus dan kesan skrin.
Bagaimana berbeza -beza elektronegativiti dalam jadual berkala?
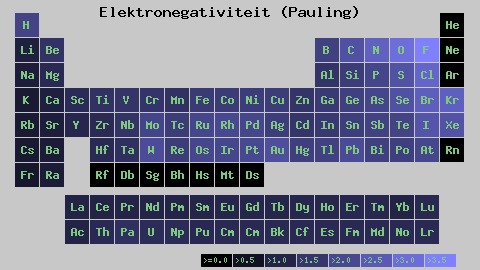 Skala Elektronegativiti Pauling. Sumber: Wikimedia Commons
Skala Elektronegativiti Pauling. Sumber: Wikimedia Commons Tidak kira skala atau nilai yang ada, elektronegativiti meningkat dari kanan ke kiri untuk tempoh, dan dari bawah ke dalam kumpulan. Oleh itu, ia meningkat ke arah pepenjuru kanan atas (tidak mengira helium) sehingga fluor adalah.
Dalam imej yang unggul, yang baru dikatakan. Dalam jadual berkala, Pauling Electronegativities dinyatakan mengikut warna kotak. Sebagai fluorida adalah elektronegatif yang paling, ia terpulang kepada warna ungu yang lebih kasar, manakala warna elektronegatif (atau elektropositif) yang kurang lebih gelap.
Ia juga dapat dilihat bahawa kepala kumpulan (H, BE, B, C, dll.) Mereka mempunyai warna yang paling jelas, dan sebagai kumpulan itu diturunkan oleh unsur -unsur lain. Apa ini? Jawapannya sekali lagi dalam sifat EI, AE, ZEF (beban nuklear yang berkesan) dan pada jejari atom.
Atom dalam molekul
Atom individu mempunyai z nuklear sebenar dan elektron luaran yang menderita produk beban nuklear yang berkesan dari kesan perisai.
Memandangkan ia bergerak dalam tempoh, Zef meningkat sedemikian rupa sehingga atom dikontrak; iaitu, radio atom dikurangkan sepanjang tempoh.
Ini mengakibatkan itu, pada masa menghubungkan satu atom dengan yang lain, elektron akan "mengalir" ke atom dengan zef yang lebih besar. Juga, ini memberikan watak ionik ke pautan jika terdapat trend elektron yang ditandakan untuk pergi ke atom. Apabila tidak, ada perbincangan mengenai ikatan kovalen.
Boleh melayani anda: kaca violetAtas sebab ini, elektronegativiti berbeza -beza mengikut radio atom, ZEF, yang seterusnya berkait rapat dengan EI dan AE. Semuanya adalah rantai.
Kegunaan elektronegativiti
Elektronegativiti berfungsi, pada dasarnya, untuk menentukan sama ada sebatian binari adalah kovalen atau ionik. Apabila perbezaan elektronegativiti sangat tinggi (pada kadar 1.7 unit atau lebih) dikatakan bahawa sebatian itu adalah ionik.
Ia juga berguna untuk membezakan dalam struktur yang kawasannya mungkin lebih kaya dengan elektron.
Dari sini ia dapat diramalkan mekanisme atau tindak balas yang dapat menderita sebatian. Di kawasan miskin elektron, δ+, mungkin spesies yang dikenakan secara negatif diperoleh dengan cara tertentu; Dan di kawasan yang kaya dengan elektron, atom mereka dapat berinteraksi dengan cara yang sangat spesifik dengan molekul lain (interaksi dipole-dipolo).
Contoh (klorin, oksigen, natrium, fluorida)
Apakah nilai elektronegativiti untuk atom klorin, oksigen, natrium dan fluorin? Selepas fluorida, siapa yang paling elektronegatif? Menggunakan jadual berkala, diperhatikan bahawa natrium mempunyai warna ungu gelap, manakala warna oksigen dan klorin sangat serupa.
Nilai elektronegativiti mereka untuk skala Pauling, Mulliken dan Allred-Rhow adalah:
Na (0.93, 1.21, 1.01).
Atau (3.44, 3.22, 3.Lima puluh).
CL (3.16, 3.54, 2.83).
F (3.98, 4.43, 4.10).
Perhatikan bahawa dengan nilai berangka terdapat perbezaan antara negativiti oksigen dan klorin.
Menurut skala Mulliken, klorin lebih banyak elektronegatif daripada oksigen, tidak seperti skala Pauling dan Allred-Rhochow. Perbezaan elektronegativiti antara kedua-dua elemen lebih jelas menggunakan skala Allred-Rhow. Dan akhirnya, fluorida, tanpa mengira skala yang dipilih, adalah yang paling elektronegatif.
Oleh itu, di mana terdapat atom f dalam molekul bermaksud bahawa pautan akan mempunyai watak ionik yang tinggi.
Rujukan
- Shiver & Atkins. (2008). Kimia bukan organik. (Edisi Keempat., p. 30 dan 44). MC Graw Hill.
- Jim Clark. (2000). Electronegives. Diambil dari: chemguide.co.UK
- Anne Marie Helmestine, Ph.D. (11 Disember 2017). Definisi dan contoh elektronegatiti. Diambil dari: Thoughtco.com
- Mark e. Tuckerman. (5 November 2011). Skala Elektronegatiti. Diambil dari: NYU.Edu
- Wikipedia (2018). Elektronegativiti. Diambil dari: ia adalah.Wikipedia.org

