Elektron dalaman

- 4307
- 1350
- Anthony Breitenberg
Kami menerangkan apa elektron dalaman, ciri -ciri mereka dan memberi beberapa contoh
Apakah elektron dalaman?
Setiap kali kita memikirkan atom, kita membayangkan nukleus yang dibentuk oleh proton dan neutron, dikelilingi oleh elektron yang berputar di sekelilingnya, sama seperti bagaimana planet berputar di sekitar matahari.
Tetapi tidak semua elektron adalah sama dan dua kelas dapat dibezakan, bergantung pada seberapa dekat atau jauh dari nukleus atom.
Ada yang lebih jauh dari nukleus dan dipanggil elektron Valencia. Ini bertanggungjawab untuk semua tindak balas kimia yang kita tahu. Sebaliknya, Mereka yang paling dekat dengan nukleus dan lebih kuat bersatu padanya, adalah yang kita panggil elektron dalaman.
Ciri -ciri elektron dalaman
Mereka adalah elektron yang paling stabil
Sebagai peraturan umum, semakin rendah tahap tenaga elektron, ini lebih stabil. Elektron dalaman menduduki orbital pada tahap tenaga terendah atom, oleh itu, mereka juga merupakan elektron yang paling stabil.
Mereka lebih kuat bersatu dengan nukleus
Nukleus menarik elektron kerana kedua -duanya mempunyai beban bertentangan: nukleus positif manakala elektron negatif. Daya ini meningkat seiring dengan jarak menurun.
Akibatnya, elektron dalaman, yang paling dekat dengan nukleus, juga yang paling dikaitkan dengan yang sama. Atas sebab yang sama, mereka juga merupakan elektron yang paling sukar untuk dikeluarkan.
Mereka bukan sebahagian daripada ikatan kimia
Apabila satu atom mendekati yang lain, perkara pertama yang disentuh adalah elektron paling luar mereka. Atas sebab ini, hanya elektron Valencia campur tangan dalam tindak balas kimia. Elektron dalaman atau tidak mengambil bahagian dalam ikatan kimia, dan tidak terlibat dalam sebarang reaksi kimia.
Ia boleh melayani anda: Berapa banyak elektron custain yang dimiliki oleh karbon?Mereka sangat melindungi
Ini bermakna bahawa elektron dalaman berdiri di antara elektron luaran dan nukleus, mewujudkan jenis skrin yang mengurangkan daya yang mana nukleus menarik elektron valensi.
Mereka selalu berpasangan
Di setiap orbital terdapat hanya dua elektron dengan putaran bertentangan, yang dipanggil elektron berpasangan (yang merupakan cara lain untuk mengatakan bahawa mereka membentuk pasangan). Seperti orbital di mana elektron dalaman terletak mereka sentiasa penuh, jadi elektron ini selalu dipasangkan.
Bagaimana kita tahu berapa banyak elektron dalaman yang ada atom?
Mengetahui berapa banyak elektron dalaman yang mempunyai atom sangat mudah. Anda hanya perlu tahu berapa banyak elektron yang ada atom, dan berapa banyak elektron yang dimiliki oleh lapisan Valencia. Semua elektron lain adalah elektron dalaman.
Tetapi bagaimana kita mengetahui nombor ini? Di bahagian berikut, kami menerangkannya.
Jumlah elektron adalah sama dengan nombor atom
Oleh kerana atom adalah neutral (iaitu, mereka tidak mempunyai caj elektrik bersih), mereka perlu mempunyai bilangan beban positif (proton) yang sama sebagai beban negatif (elektron). Oleh kerana bilangan atom menunjukkan berapa banyak proton dalam nukleus, jadi ia juga menunjukkan berapa banyak elektron atom di sekitar ketika ia neutral.
Dalam kes ion, yang tidak seperti atom mempunyai cas elektrik, jumlah bilangan elektron diperoleh dengan menolak nombor atom kecuali beban ion, dengan segala -galanya dan tanda mereka.
Contoh
- Atom karbon (c) adalah nombor elemen 6 dari jadual berkala (iaitu nombor atomnya). Oleh itu, atom karbon mempunyai 6 elektron secara keseluruhan.
- Ion natrium (i) (na+) mempunyai caj positif +1, dan bilangan natrium atom adalah 11. Jadi jumlah elektron ion ini adalah: 11 - (+1) = 10 elektron.
- Ion klorida (CL-) mempunyai beban negatif -1, dan bilangan klorin atom adalah 17. Jadi jumlah elektron ion ini adalah: 17 - ( - 1) = 17 + 1 = 18 elektron.
Bilangan elektron Valencia sama dengan kumpulan mereka dalam jadual berkala
Unsur -unsur yang dimiliki oleh Kumpulan 1A (Logam Alkali) semuanya mempunyai 1 elektron Valencia. Mereka milik ke -2 (alkaliner) mempunyai 2, yang ke -3 (Boro Group, Aluminium, Gallium, dll.) Mereka mempunyai 3 dan sebagainya. Ini tidak berlaku untuk logam peralihan.
Seperti sebelumnya, ion dikurangkan daripada mengira elektron valensi mereka.
Contoh
- Oksigen milik kumpulan 6a untuk apa yang mempunyai 6 elektron valensi.
- Ion sulfida (s2-) Ia juga tergolong dalam kumpulan 6a, tetapi mempunyai beban -2, jadi ia mempunyai: 6 -( -2) = 6 + 2 = 8 elektron Valencia.
Contoh atom yang berbeza dan elektron dalaman mereka
Elektron karbon dalaman (c)

Seperti yang kita lihat sebentar tadi, karbon mempunyai 6 elektron. Di samping itu, ia tergolong dalam kumpulan 4A untuk apa yang mempunyai 4 elektron Valencia, jadi, jumlahnya 6 - 4 = 2 elektron dalaman.
Elektron nitrogen dalaman (n)
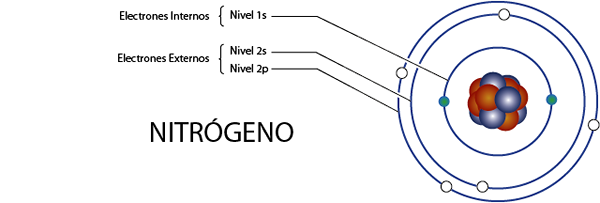
Nitrogen mempunyai 7 elektron secara keseluruhan. Di samping itu, ia tergolong dalam Kumpulan 5A untuk apa yang mempunyai 5 elektron Valencia, jadi, jumlahnya 7 - 5 = 2 elektron dalaman.
Elektron dalaman argon (AR)
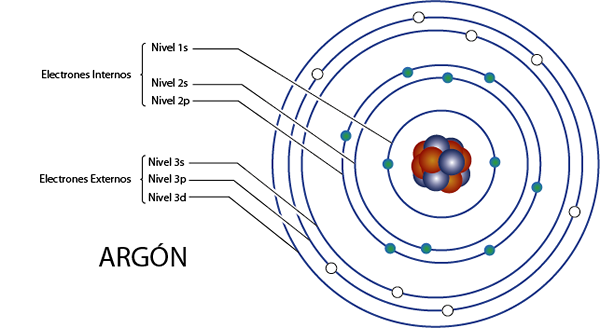
Argon adalah elemen 18 untuk apa yang mempunyai 18 elektron. Di samping itu, ia adalah milik Kumpulan 8a untuk apa yang mempunyai 8 elektron Valencia, jadi, jumlahnya 18 - 8 = 10 elektron dalaman.
Elektron dalaman ion klorida (CL-)
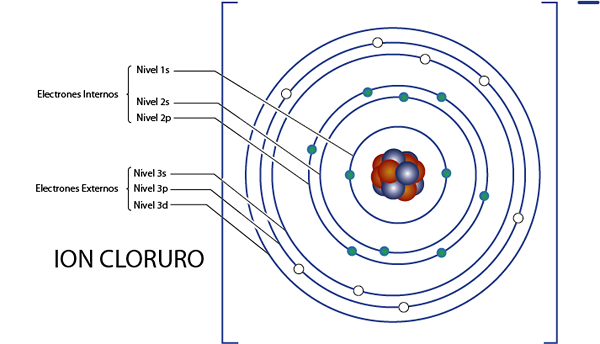
Seperti yang kita lihat sebentar tadi, klorida mempunyai 18 elektron secara keseluruhan. Di samping itu, ia tergolong dalam kumpulan 7A dan mempunyai beban -1, jadi ia mempunyai 7 - ( - 1) = 8 elektron Valencia. Jadi ia mempunyai 18 - 8 = 10 elektron dalaman, Seperti argon.
Ia boleh melayani anda: Kimia Nuklear: Sejarah, Bidang Pengajian, Kawasan, AplikasiElektron dalaman kalsium +2 ion (ca2+)
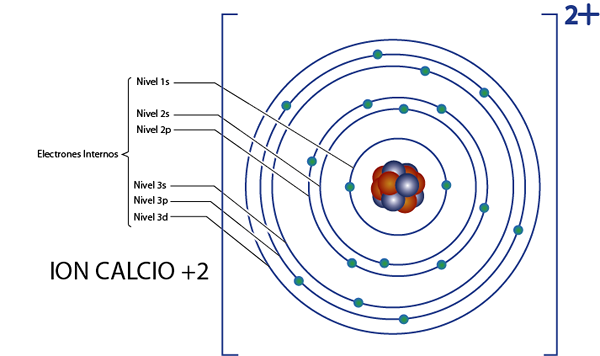
Kalsium adalah elemen 20, dan ion ini mempunyai 2 caj positif, jadi ia mempunyai jumlah 20 - 2 = 18 elektron sekitar nukleus. Unsur ini milik kumpulan 2a dan sebagai bebannya adalah +2, maka ia tidak mempunyai elektron valensi (2 - 2 = 0). Atas sebab ini, semua 18 elektron yang ditinggalkan oleh kalsium adalah yang pada asalnya adalah elektron dalaman.
Terdapat dua elemen yang tidak mempunyai elektron dalaman
Dua elemen yang lebih ringan dari jadual berkala, yang masing -masing hidrogen (h) dan helium (dia), hanya mempunyai 1 dan 2 elektron masing -masing. Kedua -dua elektron berada pada tahap satu -satunya tenaga yang mempunyai atom -atom ini, iaitu tahap 1.
Atas sebab ini, elektron ini sesuai dengan elektron valensi kedua -dua elemen ini. Kerana tidak ada tahap tenaga yang lebih rendah, maka tidak ada juga elektron dalaman.

