Tenaga dalaman

- 1494
- 133
- Julius Dibbert
Kami menerangkan tenaga dalaman apa, fungsinya, bagaimana mengira dan memberikan beberapa contoh
 Rajah menunjukkan sumbangan kepada tenaga dalaman sistem. Sumber: f. Zapata
Rajah menunjukkan sumbangan kepada tenaga dalaman sistem. Sumber: f. Zapata Apa itu Tenaga Dalaman?
The tenaga dalaman Dari objek berasal dari pergerakan rawak yang atom dan molekul yang membentuknya. Walaupun objek itu sempurna di rehat, di dalam, di tahap mikroskopik, zarah -zarah yang membentuknya bergerak secara berterusan tanpa berehat.
Oleh kerana zarah -zarah ini bergerak, mereka mempunyai tenaga kinetik, yang merupakan sebahagian daripada tenaga dalaman mereka. Sumbangan lain kepada tenaga dalaman adalah tenaga berpotensi yang berasal dari daya intermolecular, yang bertanggungjawab untuk mengekalkan perpaduan bahan.
Daya intermolecular ini biasanya berasal dari elektromagnet, tetapi daya graviti dan nuklear juga mengambil bahagian.
Sekarang, bergantung kepada jenis pergerakan zarah, tenaga kinetik boleh:
- Translasi
- Getaran
- Putaran
Suhu hanya mengukur tenaga kinetik translasi zarah. Pada dasarnya, pada suhu yang lebih besar, tenaga dalaman akan lebih besar, tetapi ini juga bergantung pada jisim. A Contoh Isu ini menjelaskan: gelas dengan air suam mempunyai tenaga dalaman yang kurang daripada tasik pada suhu bilik, walaupun suhu kaca lebih tinggi, dan itu kerana terdapat lebih banyak air di tasik daripada di kaca.
Walau apa pun, tenaga dalaman bahan tidak dapat dilihat, ia tidak bergantung kepada pergerakannya, dan tidak bergantung pada kedudukan relatifnya berkenaan dengan objek lain. Sebagai contoh, tenaga dalaman kaca dengan air pada suhu bilik adalah sama jika kaca berada di atas meja atau jika berada di lantai.
Boleh melayani anda: vektor bukan -planar: definisi, syarat, latihanFungsi tenaga dalaman
Tenaga dalaman, yang biasanya dilambangkan sebagai u, adalah fungsi yang bergantung kepada pembolehubah termodinamik sistem, seperti suhu t dan isipadu v. Oleh itu, ia boleh dinyatakan secara matematik sebagai:
U = u (t, v)
Pada hakikatnya, nilai mutlak tenaga dalaman sistem tidak relevan, yang penting adalah variasi, yang dilambangkan dengan huruf Yunani δ ("delta"):
ΔU = u permulaan - Atau final
Sekarang, tenaga dalaman boleh diubah jika haba ditambah atau diekstrak. Menambah Haba Ada kemungkinan sistem melakukan pekerjaan tertentu, seperti omboh dalam silinder enjin.
Undang -undang termodinamik pertama
Dari undang -undang termodinamik pertama, ia ditetapkan bahawa Variasi tenaga dalaman Dari sistem yang setara dengan:
Δu = q - w
Di mana berapa jumlah haba yang dipindahkan ke sistem dan w adalah kerja yang dilakukan oleh sistem, sekiranya ia melakukan beberapa. Segala -galanya diukur dalam joules dalam sistem unit antarabangsa.
Sekiranya sistem tidak berfungsi, maka haba yang dibekalkan digunakan secara keseluruhan untuk meningkatkan tenaga dalaman sistem.
Berikut adalah dari ungkapan sebelumnya:
- ΔU> 0 bermaksud bahawa sistem meningkatkan tenaga dalamannya
- ΔU < 0 la energía interna del sistema disminuye
- Q> 0 Sistem menyerap haba
- W> 0 sistem tidak berfungsi.
Cara mengira tenaga dalaman?
Gas ideal monoatomik
Dalam model gas ideal monoatomik (satu atom), zarah tidak berinteraksi antara satu sama lain, supaya tenaga kinetik translasi adalah satu -satunya sumbangan kepada tenaga dalaman atau gas. Ada teorem, yang dipanggil Teorem Equiparition, yang menyatakan bahawa setiap tahap kebebasan mempunyai tenaga yang sama dengan:
Ia dapat melayani anda: difraksi gelombang: konsep dan contohDi mana t ialah suhu dan r adalah pemalar gas ideal, yang nilai dalam unit sistem antarabangsa adalah:
8.314472 J/mol ∙ k
Tahap kebebasan mewakili kemungkinan bergerak sepanjang arah tertentu di ruang angkasa. Zarah gas yang ideal boleh bergerak ke tiga arah ruang, oleh itu, tenaga naphes gas adalah:
Jumlah haba
Dengan mengandaikan bahawa haba ditambah kepada sistem dan ini tidak berfungsi, haba ini hanya digunakan untuk meningkatkan tenaga dalaman sistem. Jumlah haba yang mesti berkadar dengan jisim m sistem dan perubahan suhu:
Q ∝ m ⋅ΔT
Pemalar perkadaran bergantung pada bahan dan dipanggil haba tertentu. Memanggil C ke pemalar ini, haba adalah:
Q = MC ⋅ΔT
Apabila haba dibalikkan dalam meningkatkan tenaga dalaman:
Q = mc ⋅Δt = ΔU
ΔU sepadan dengan variasi Dalam tenaga dalaman.
Contoh tenaga dalaman
1. Variasi suhu
Perubahan suhu bahan seterusnya menjana perubahan dalam tenaga dalaman mereka. Inilah yang berlaku, sebagai contoh, semasa memasak. Dengan memanaskan makanan, pergolakan molekulnya meningkat, tenaga kinetik meningkat dan oleh itu tenaga dalamannya.
2. Tenaga dalaman dua bahan pada suhu yang sama
Dua bahan pada suhu yang sama tidak semestinya mempunyai tenaga dalaman yang sama, kerana ia bergantung kepada dua sumbangan: tenaga kinetik dan tenaga berpotensi.
Sekiranya bahan pada suhu yang sama, dapat disahkan bahawa tenaga kinetik translasi zarahnya adalah sama, tetapi tenaga yang berpotensi berbeza, kerana ini bergantung pada konfigurasi atom konstituen.
Boleh melayani anda: tekanan hidrostatik: formula, pengiraan, contoh, latihan3. Pengembangan haba
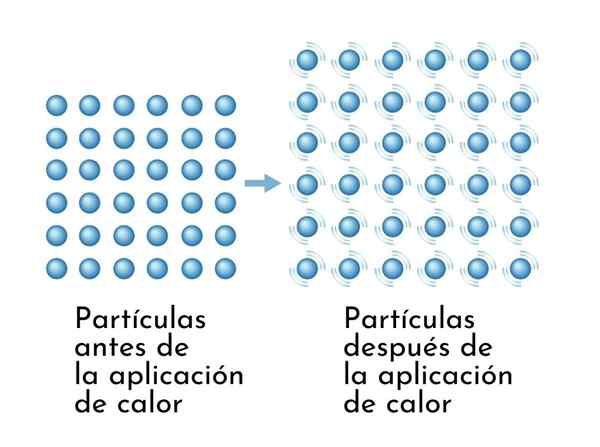 Bahan berkembang apabila dipanaskan, kerana peningkatan tenaga dalaman menyebabkan zarah mereka bergetar dengan lebih meluas, jadi dimensi meningkat
Bahan berkembang apabila dipanaskan, kerana peningkatan tenaga dalaman menyebabkan zarah mereka bergetar dengan lebih meluas, jadi dimensi meningkat Akibat yang kelihatan dari bahan pemanasan adalah peningkatan dalam dimensi mereka, kerana jarak purata antara atomnya meningkat.
Daya intermolecular boleh disimulasikan melalui mata air yang menyatukan atom.
4. Gas termampat
Gas termampat boleh menyimpan tenaga dalaman, kerana ketumpatannya meningkat dengan mengurangkan jumlah dan dengan itu interaksi dengan dinding bekas bekas. Dengan cara ini gas termampat dapat melakukan pekerjaan seperti menggerakkan omboh.
5. Bateri
Dalam tindak balas kimia bateri berlaku mampu menjana arus elektrik sebaik sahaja litar ditutup. Tenaga potensi kimia ini dianggap sebagai sebahagian daripada tenaga dalaman sistem.
6. Sistem yang menyerap haba dan berfungsi
Apabila sistem menyerap haba, ia meningkatkan tenaga dalamannya. Tetapi jika pada masa yang sama dia melakukan pekerjaan, undang -undang termodinamik pertama dapat digunakan untuk mengetahui berapa banyak perubahan tenaga dalaman. Sebagai contoh, dengan mengandaikan bahawa sistem menyerap 175 j haba dan melakukan pekerjaan yang setara dengan 62 j, perubahan tenaga dalamannya adalah:
Δu = q - w = 175 j - 62 j = 113 j.



