Ciri dan contoh pautan kovalen kutub
- 2824
- 852
- Donnie Ryan
A Ikatan kovalen kutub Ia adalah yang terbentuk antara dua elemen kimia yang perbezaan elektronegativiti adalah besar, tetapi tanpa menghampiri watak murni ionik. Oleh itu, interaksi kuat pertengahan antara ikatan kovalen apolar dan pautan ionik.
Dikatakan bahawa ia adalah kovalen kerana dalam teori terdapat perkongsian saksama pasangan elektronik antara kedua -dua atom yang dipautkan; iaitu, kedua -dua elektron dikongsi bersama. Atom e · menyumbangkan elektron, manakala · x menyediakan elektron kedua untuk membentuk ikatan kovalen E: x atau e-x.
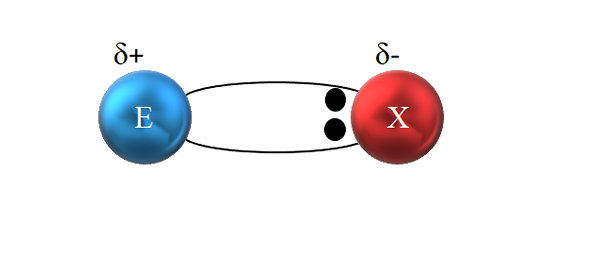
 Dalam ikatan kovalen kutub, pasangan elektron tidak dikongsi bersama. Sumber: Gabriel Bolívar.
Dalam ikatan kovalen kutub, pasangan elektron tidak dikongsi bersama. Sumber: Gabriel Bolívar. Walau bagaimanapun, seperti yang dilihat dalam imej yang unggul, kedua -dua elektron tidak terletak di tengah E dan X, menunjukkan bahawa mereka "mengedarkan" dengan kekerapan yang sama antara kedua -dua atom; tetapi lebih dekat dengan x daripada e. Ini bermakna X telah menarik sepasang elektron ke arahnya kerana elektronegativiti yang lebih besar.
Sebagai elektron pautan lebih dekat dengan x daripada E, sekitar x rantau ketumpatan elektronik yang tinggi dicipta, δ-; Semasa berada di kawasan miskin muncul dalam elektron, δ+. Oleh itu, terdapat polarisasi caj elektrik: ikatan kovalen kutub.
[TOC]
Ciri -ciri
Darjah polariti
Ikatan kovalen sangat banyak. Mereka praktikal hadir dalam semua molekul heterogen dan sebatian kimia; Oleh kerana, selepas semua, ia dibentuk apabila dua atom yang berbeza e dan x dikaitkan. Walau bagaimanapun, terdapat lebih banyak ikatan kovalen kutub daripada yang lain, dan untuk mengetahui bahawa anda mesti menggunakan elektronegativiti.
Berapa banyak lagi elektronegatif adalah x, dan kurang elektronegatif e e (elektropositif), maka ikatan kovalen yang terhasil akan lebih kutub. Mod konvensional untuk menganggarkan polariti ini adalah melalui formula:
Boleh melayani anda: Natrium borohidrida (NABH4): Struktur, sifat, kegunaanχX - χDan
Di mana χ adalah elektronegativiti setiap atom mengikut skala Pauling.
Sekiranya penolakan atau penolakan ini mempunyai nilai antara 0.5 dan 2, maka ia akan menjadi pautan kutub. Oleh itu, adalah mungkin untuk membandingkan tahap polariti antara beberapa pautan e-x. Sekiranya nilai yang diperolehi lebih tinggi daripada 2, terdapat perbincangan mengenai pautan ionik, dan+X- Dan tidakδ+-Xδ-.
Walau bagaimanapun, polariti pautan E-X tidak mutlak, tetapi bergantung kepada persekitaran molekul; Iaitu, dalam molekul -e-x-, di mana e dan x membentuk ikatan kovalen dengan atom lain, yang kedua secara langsung mempengaruhi tahap polaritas.
Unsur kimia yang berasal dari mereka
Walaupun E dan X boleh menjadi elemen, tidak semua berasaskan ikatan kovalen kutub. Sebagai contoh, jika E adalah logam yang sangat elektropositif, seperti alkali (li, na, k, rb dan cs), dan x halogen (f, cl, br dan i), mereka akan cenderung membentuk sebatian ionik (na+Cl-) dan bukan molekul (NA-CL).
Itulah sebabnya ikatan kovalen kutub biasanya antara dua elemen bukan logam; dan ke tahap yang lebih rendah, antara unsur -unsur bukan logam dan beberapa logam peralihan. Melihat blok p Dari jadual berkala, terdapat banyak pilihan untuk membentuk pautan kimia jenis ini.
Watak kutub dan ionik
Dalam molekul besar, tidak penting untuk memikirkan bagaimana pautan polar; Ini sangat kovalen, dan pengedaran caj elektrik mereka (di mana kawasan elektron yang kaya atau miskin) lebih perhatian untuk menentukan tahap kovalensi hubungan dalaman mereka.
Boleh melayani anda: kromatografi gasWalau bagaimanapun, dengan molekul diatomik atau kecil, kata polariti danδ+-Xδ- Ia agak relatif.
Ini bukan masalah dengan molekul yang terbentuk antara unsur -unsur bukan metallic; Tetapi apabila logam peralihan atau metalloid mengambil bahagian, tidak lagi hanya bercakap tentang ikatan kovalen kutub, tetapi ikatan kovalen dengan watak ionik tertentu; dan dalam hal logam peralihan, pautan koordinasi kovalen memandangkan sifat yang sama.
Contoh Bon Kovalen Polar
Co
Ikatan kovalen antara karbon dan oksigen adalah kutub, kerana yang pertama kurang elektronegatif (χC = 2.55) yang kedua (χSama ada = 3.44). Oleh itu, apabila kita melihat pautan c-o, c = o o c-o-, Kita akan tahu bahawa mereka adalah pautan kutub.
H-X
Halogenida hidrogen, HX, adalah contoh yang ideal untuk memahami ikatan kutub dalam molekul diatom mereka. Mempunyai elektronegativiti hidrogen (χH = 2.2), kita boleh menganggarkan bagaimana polar halogenuros ini:
-HF (H-F), χF (3.98) - χH (2,2) = 1.78
-HCl (H-CL), χCl (3,16) - χH (2,2) = 0.96
-Hbr (H-Br), χBr (2.96) - χH (2,2) = 0.76
-Hai (h-i), χYo (2.66) - χH (2,2) = 0.46
Perhatikan bahawa mengikut pengiraan ini, pautan H-F adalah yang paling kutub dari semua. Sekarang, apakah watak ioniknya yang dinyatakan sebagai peratusan, adalah topik lain. Hasil ini tidak menghairankan kerana fluorin adalah elemen elektronegatif yang paling banyak dari semua.
Apabila elektronegativiti turun dari klorin ke iodin, pautan H-CL, H-BR dan H-I menjadi kurang kutub. Pautan H-I harus apolar, tetapi pada hakikatnya ia adalah kutub dan juga "rapuh"; pecah dengan mudah.
Boleh melayani anda: Mercury hidroksida: struktur, sifat, kegunaan, risikoO-H
Pautan Polar O-H mungkin yang paling penting dari semua: terima kasih kepadanya ada kehidupan, kerana dia bekerjasama dengan momen dipole air. Jika kita menganggarkan perbezaan antara elektronegativiti oksigen dan hidrogen kita akan mempunyai:
χSama ada (3.44) - χH (2,2) = 1.24
Walau bagaimanapun, molekul air, h2Atau, ia mempunyai dua pautan ini, H-O-H. Ini, dan geometri sudut molekul dan asimetrinya, menjadikannya sebatian yang sangat kutub.
N-H
Pautan N-H hadir dalam kumpulan protein amino. Mengulangi pengiraan yang sama yang kita ada:
χN (3.04) - χH (2,2) = 0.84
Ini mencerminkan bahawa pautan N-H kurang kutub daripada O-H (1,24) dan F-H (1,78).
Jelek
Pautan Fe-O adalah penting kerana oksida mereka terdapat dalam mineral besi. Mari kita lihat sama ada ia lebih kutub daripada H-O:
χSama ada (3.44) - χIman (1.83) = 1.61
Dari sini ia betul-betul sepatutnya, bahawa pautan Fe-O lebih kutub daripada pautan H-O (1,24); atau apa yang sama seperti berkata: Fe-O mempunyai watak ionik yang lebih besar daripada H-O.
Pengiraan ini berfungsi untuk muncul darjah polariti antara beberapa pautan; Tetapi mereka tidak mencukupi untuk memerintah sama ada sebatian adalah ionik, kovalen, atau watak ioniknya.
Rujukan
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (8th ed.). Pembelajaran Cengage.
- Shiver & Atkins. (2008). Kimia bukan organik. (Edisi Keempat). MC Graw Hill.
- Laura Nappi. (2019). Bon kovalen kutub dan nonpolar: definisi dan contoh. Kajian. Pulih dari: belajar.com
- Helmestine, Anne Marie, Ph.D. (18 September 2019). Definisi dan contoh ikatan kutub (ikatan kovalen kutub). Pulih dari: Thoughtco.com
- Elsevier b.V.(2019). Ikatan kovalen kutub. Scientedirect. Diperoleh dari: Scientedirect.com
- Wikipedia. (2019). Polaritas kimia. Diperoleh dari: dalam.Wikipedia.org
- Tanpa nama. (5 Jun, 2019). Sifat ikatan kovalen kutub. Kimia Librettexts. Pulih dari: chem.Libretxts.org

