Entalpi reaksi, termokimia, latihan

- 3476
- 593
- Julius Dibbert
The entalpi reaksi Ia adalah fungsi termodinamik yang membolehkan anda mengira haba yang diperoleh atau diserahkan kepada tindak balas kimia, dengan syarat reaksi ini telah berlaku pada tekanan tetap. Ia ditakrifkan sebagai tenaga dalaman atau ditambah produk tekanan p oleh volum v bahan yang terlibat dalam tindak balas kimia, seperti berikut: H = U + P ∙ V
Oleh itu entalpi mempunyai dimensi tenaga, dan dalam sistem langkah -langkah antarabangsa ia diukur dalam joules. Untuk memahami hubungan entalpi dengan haba yang ditukar dalam tindak balas kimia, perlu mengingati undang -undang termodinamik pertama, yang menetapkan yang berikut: q = Δu + w
 Rajah 1. Dalam pembakaran gas, entalpi berkurangan. Sumber: Pixabay
Rajah 1. Dalam pembakaran gas, entalpi berkurangan. Sumber: Pixabay Undang -undang pertama menetapkan bahawa haba yang ditukar dalam proses termodinamik adalah sama dengan variasi tenaga dalaman bahan -bahan yang terlibat dalam proses ditambah kerja yang dijalankan oleh bahan -bahan ini dalam proses.
Dalam mana -mana proses w kerja dikira oleh hubungan berikut:

Dalam ungkapan sebelumnya VI adalah jumlah awal, vf jumlah akhir dan p tekanan. Jika proses dijalankan di bawah tekanan malar p, maka kerja yang dihasilkan akan:
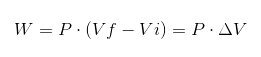
Di mana ΔV ialah variasi kelantangan.
[TOC]
Definisi
Reaksi kimia adalah proses termodinamik yang umumnya berlaku di bawah tekanan malar dan sangat kerap pada tekanan atmosfera. Proses termodinamik jenis ini dipanggil "isobaric", kerana ia berlaku pada tekanan tetap.
Dalam hal ini undang -undang termodinamik pertama dapat ditulis seperti ini:
Qp = Δu + p ∙ ΔV
Di mana QP menunjukkan bahawa haba telah ditukar pada tekanan berterusan. Jika definisi entalpi h = u + p ∙ v diperoleh maka:
Qp = ΔH
Dari sana anda perlu mengubah entalpi positif menunjukkan tindak balas yang telah mengambil haba dari persekitaran. Ini adalah tindak balas endotermik.
Boleh melayani anda: tan: transformasi, kesetaraan dan latihan diselesaikanSebaliknya, jika perubahan entalpi adalah negatif, maka reaksi eksotermik.
Malah, perkataan entalpi berasal dari perkataan Yunani Entalpien, maksudnya adalah "panas".
Kerap entalpi juga dipanggil haba. Tetapi mesti jelas bahawa ia tidak sama dengan haba, tetapi ia adalah pertukaran haba semasa proses termodinamik yang mengubah entalpi.
Hubungan haba
Tidak seperti haba, entalpi adalah fungsi negara. Apabila perubahan entalpi dikira, perbezaan dua fungsi yang bergantung secara eksklusif pada status sistem seperti tenaga dalaman dan kelantangan sedang dikira.
ΔH = ΔU + p ∙ ΔV
Seperti dalam tindak balas tekanan tetap berterusan, jadi entalpi reaksi adalah fungsi keadaan yang hanya bergantung kepada tenaga dan kelantangan dalaman.
Dalam tindak balas kimia, enthalpi reagen boleh ditakrifkan sebagai jumlah masing -masing; dan produk sebagai jumlah entalpi semua produk.
Perubahan entalpi dalam tindak balas adalah perbezaan produk kecuali reagen:

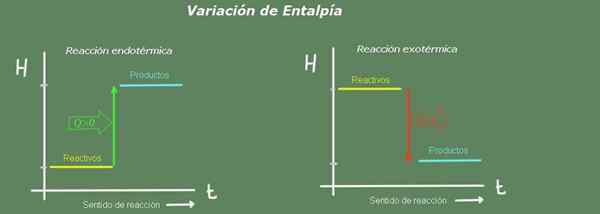 Rajah 2. Rajah entalpi. Sumber: Diri Diri.
Rajah 2. Rajah entalpi. Sumber: Diri Diri. Dalam tindak balas endotermik, entalpi produk lebih besar daripada reagen; iaitu, tindak balas mengambil haba dari persekitaran. Sebaliknya, dalam tindak balas eksotermik, entalpi reagen lebih besar daripada produk, kerana reaksi memberikan haba kepada alam sekitar.
Entalpi standard
Oleh kerana perubahan entalpi dalam tindak balas kimia boleh bergantung kepada tekanan dan suhu, adalah kebiasaan untuk menentukan keadaan reaksi standard:
Ia boleh melayani anda: lengkung penentukuran: Apa itu, bagaimana untuk melakukannya, contohnyaSuhu tindak balas standard: 25 ° C.
Tekanan tindak balas standard: 1 atm = 1 bar.
Enthalpy standard dilambangkan seperti berikut: H °
Thermochemistry
Dalam persamaan termokimia bukan sahaja penting reagen dan produk, variasi entalpi juga penting. Entalpi difahami sebagai tindak balas terhadap perubahannya yang mempunyai tempat yang sama.
Sebagai contoh, mari kita lihat reaksi berikut:
2 H2 (Gas) + O2 (Gas) → 2 H2O (Cecair); ΔH ° = -571.6 kJ (exothermic).
H2 (gas) + (½) O2 (gas) → H2O (cecair); ΔH ° = -285.8 kJ (exothermic).
2 H2O (cecair) → 2 h2 (gas) + O2 (gas); ΔH ° = +571.6 kJ (endothermic).
Entalpi adalah jumlah termodinamik yang luas
Sekiranya syarat persamaan kimia didarabkan atau dibahagikan dengan faktor tertentu, maka entalpi didarabkan atau dibahagikan dengannya.
Sekiranya tindak balas dilaburkan, maka tanda entalpi reaksi juga dilaburkan.
Latihan yang diselesaikan
-Latihan 1
Gas asetilena C2H2 diperolehi dari reaksi kalsium karbida CAC2 yang datang dengan cara yang granulasi dengan air di alam sekitar dan tekanan alam sekitar.
Sebagai data, terdapat enthalpies pembentukan reagen:
ΔH ° (CAC2) = -59.0 kJ/mol
ΔH ° (H20) = -285.8 kJ/mol
Dan entalpi pembentukan produk:
ΔH ° (C2H2) = +227.0 kJ/mol
ΔH ° (Ca (OH) 2) = -986.0 kJ/mol
Cari entropi standard reaksi.
Penyelesaian
Perkara pertama ialah meningkatkan persamaan kimia yang seimbang:
CAC2 (s) + 2H20 (l) → Ca (OH) 2 (s) + C2H2 (g)
Dan sekarang enthalpies reagen, produk dan reaksi:
- Reagen: -59.0 kJ/mol -2 ∙ 285.8 kJ/mol = -630.6 kJ/mol
- Produk: -986.0 kJ/mol + 227.0 kJ/mol = -759 kJ/mol
Ia boleh melayani anda: Apakah vektor coplanares? (Dengan latihan yang diselesaikan)- Reaksi: ΔH ° = -759 kJ/mol -( -630 kJ/mol) = -129 kJ/mol
Ia adalah reaksi eksotermik.
-Latihan 2
Apabila 1 liter asetilena terbakar dalam keadaan standard, berapa banyak haba yang dilepaskan?
Penyelesaian
Reaksi pembakaran asetilena sekali seimbang adalah seperti ini:
C2H2 (g) + (5/2) O2 (g) → 2 CO2 (g) + H20 (L)
Kami memerlukan enthalpies latihan produk:
ΔH ° (CO2) = -393.5 kJ/mol
ΔH ° (H2O (L)) = -285.8 kJ/mol
Pengiraan enthalpies
Dengan data ini kita dapat mengira entalpi produk:
ΔH ° (produk) = 2*(-393.5 kJ/mol) + (-285.8 kJ/mol) = -1072.8 kJ/mol
Dan entalpi pembentukan reagen:
ΔH ° (C2H2) = 227.0 kJ/mol
ΔH ° (o2) = 0.0 kJ/mol
Enthalpy reagen akan menjadi:
227.0 kJ/mol + (5/2)* 0.0 = 227.0 kJ/mol
Entalpi tindak balas molar akan menjadi: ΔH ° (produk) - ΔH ° (reagen) = -1072.8kj/mol - 227.0 kJ/mol = -1299.8 kJ/mol
Entalpi pembakaran
Sekarang kita perlu tahu berapa banyak tahi lalat asetilena adalah liter asetilena dalam keadaan standard. Untuk ini kita akan menggunakan persamaan negeri gas yang ideal, dari mana kita akan membersihkan bilangan tahi lalat.
Bilangan tahi lalat n = p*v/(r*t)
P = 1 atm = 1.013 x 10⁵ Pa
V = 1 L = 1.0 x 10^-3 m³
R = 8.31 j/(mol*k)
T = 25 ° C = 298.15 k
N = 0.041 mol
Enthalpy pembakaran 1 liter asetilena adalah 0.041 mol * (-129.8 kJ/mol) = -53,13 kJ
Tanda negatif menunjukkan bahawa ia adalah tindak balas eksotermik yang mengeluarkan 53.13 kJ = 12.69 kcal.
Rujukan
- Castaños e. Entalpi dalam tindak balas kimia. Pulih dari: lidiaconlachimica.WordPress.com
- Thermochemistry. Entalpi reaksi. Diperolehi dari: Sumber.pendidikan.adalah
- Thermochemistry. Definisi entalpi reaksi standard. Pulih dari: quimitube.com
- Wikipedia. Entalpi reaksi standard. Pulih dari: wikipedia.com
- Wikipedia. Entalpi latihan. Pulih dari: wikipedia.com
- « Formula ralat relatif, bagaimana ia dikira, latihan
- Apakah usaha tugasan dan bagaimana untuk mendapatkannya? »

