Baki wap cecair

- 2190
- 46
- Erick Krajcik
Apakah baki wap cecair?
Dia baki wap cecair Ia adalah keadaan dinamik yang menetapkan cecair, sama ada bahan murni atau campuran, dengan stim yang mengelilingi dan berinteraksi dengan permukaannya. Untuk berlaku bekas mesti ditutup, jika tidak, arus udara akan menyebabkan cecair menguap perlahan -lahan.
Apabila sistem ditutup, tekanan yang dikenakan oleh molekul fasa stim akan memanjat seiring dengan berlalunya waktu. Titik akan datang di mana tekanan akan berhenti; Ini adalah tekanan wap cecair, yang merupakan harta fizikal perkara itu, yang bebas daripada saiz bekas, atau jumlah cecair.
 Apabila minuman gas ditemui, keseimbangan wap cairnya terganggu, menyebabkan ketidakseimbangan tekanan di luar dan di dalam botol, dan dengan itu bubb. Sumber: Openstax, CC oleh 4.0, melalui Wikimedia Commons
Apabila minuman gas ditemui, keseimbangan wap cairnya terganggu, menyebabkan ketidakseimbangan tekanan di luar dan di dalam botol, dan dengan itu bubb. Sumber: Openstax, CC oleh 4.0, melalui Wikimedia Commons Setiap cecair, tulen atau bercampur, akan mempunyai tekanan wap yang berkaitan yang bergantung kepada ketidaktentuan komponennya; Dan oleh itu, daya intermolecular yang menyimpannya bersama dalam cecair dan di permukaannya.
Tekanan ini dapat diterangkan dengan mengandaikan idealitas penyelesaian, atau kemungkinan komponen campuran. Untuk melakukan ini, penggunaan gambar rajah binari sangat berguna, di mana mungkin untuk merenungkan daya maju proses pemisahan.
Keseimbangan wap cecair adalah penting untuk infiniti proses kejuruteraan kimia, seperti penyulingan pecahan dan yang dibuat dengan wap air, yang mana sulingan sulingan dalam komponen yang paling tidak menentu diperolehi. Ini adalah kes etanol pada 95.4% di dalam air, menjadi peratusan alkohol yang paling mudah diakses dan ekonomi di pasaran.
Bahan tulen
Molekul bahan murni masih belum, tetapi bergerak dari satu tempat ke tempat lain terima kasih kepada tenaga kinetik intrinsik. Tenaga ini kadang -kadang cukup besar untuk mengatasi daya intermolecular yang "menarik" molekul dari tertentu ke pangkuan cecair. Kemudian, molekul akan melarikan diri dari permukaan cecair ke fasa stim.
Dalam fasa stim, molekul akan bertembung dengan dinding dalaman bekas, menang atau kehilangan kelajuan sehingga mereka menyatukan semula dengan permukaan cecair, di mana sekali mereka pergi untuk mengintegrasikan konglomerat molekul fasa cecair.
Boleh melayani anda: kobalt: struktur, sifat, aplikasiOleh itu, masa akan berlaku sehingga, pada suhu tertentu (untuk mengatakan 25 ° C), bilangan molekul yang melarikan diri dari permukaan sama dengan yang masuk dari stim. Oleh itu, dikatakan bahawa keseimbangan wap cecair telah ditubuhkan dalam bahan murni untuk.
Tekanan wap untuk mengalami dinding dalaman bekas, serta permukaan cecair, akan sama dengan pKeº, yang tetap dan boleh dihasilkan; Tidak kira seberapa besar atau kecil bekas itu atau jumlah cecair yang dipertimbangkan.
Campuran
Dalam campuran cecair terdapat juga komponen yang memberi tekanan pada permukaan cecair dan kontur kontena. Tekanan stim anda, seperti yang dijangkakan, akan terdiri daripada sumbangan dari setiap komponen campuran, untuk mengatakan, dua bahan a dan b. Campuran ini boleh dilarutkan, sebahagiannya boleh dilarutkan.
Boleh didapati
Dalam campuran yang loskan antara A dan B, kedua -dua bahan membentuk satu fasa, yang pada pandangan pertama kelihatan seperti bahan murni. Oleh itu, menurut undang -undang Dalton, tekanan campuran atau penyelesaian akan sama dengan:
Pmatahari = PKe + PB +··· pYo
Menjadi pYo mana -mana komponen lain yang juga terdapat dalam campuran. Perhatikan bahawa pKe≠ pKeº, iaitu tekanan bahan dalam campuran tidak sama dengan keadaan kesucian yang tinggi.
Apabila mengandaikan bahawa penyelesaiannya sesuai, perbezaan antara interaksi A-A, B-B dan A-B jelas. Ini boleh digunakan, sebagai contoh, dalam campuran etanol dan metanol.
Oleh itu, tekanan wap komponen dalam campuran akan bergantung kepada jumlah relatifnya dalam fasa cecair, dinyatakan sebagai pecahan molar xYo. Dan ini adalah di mana undang -undang Raault campur tangan, yang bertujuan untuk mengaitkan tekanan pKe Dan pKeº:
PKe = XKe PKeº
Menjadi sekarang jumlah tekanan yang sama dengan:
Pmatahari = XKe PKeº + xB PBº +···
Fasa stim, sebaliknya, akan mempunyai komposisi sendiri, dinyatakan sebagai pecahan molar yi:
Yi = pYo / Pmatahari
= XYo PYoº / pmatahari
Gambar rajah binari
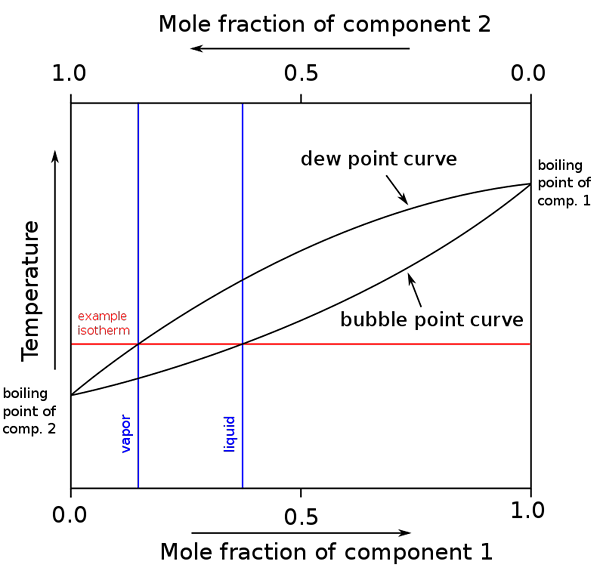 Rajah titik mendidih dan komposisi molar untuk campuran binari. Sumber: binary_boiling_point_diagram.PNG: H Padleckasderivative Work: Michbich, CC BY-SA 2.5, melalui Wikimedia Commons
Rajah titik mendidih dan komposisi molar untuk campuran binari. Sumber: binary_boiling_point_diagram.PNG: H Padleckasderivative Work: Michbich, CC BY-SA 2.5, melalui Wikimedia Commons Apabila pecahan molar komponen campuran binari (a + b) adalah grafik, bergantung kepada suhu atau tekanan, gambar rajah binari diperoleh (lihat di atas). Bentuk tertentu ini, yang paling mudah, sepadan dengan penyelesaian yang ideal.
Boleh melayani anda: Volume Molar: Konsep dan Formula, Pengiraan dan ContohKawasan di atas "bujur" sepadan dengan fasa stim, manakala kawasan di bawah sepadan dengan fasa cecair campuran. Perhatikan bahawa apabila pecahan molar komponen 1 atau 0 (x1= 0), pecahan molar komponen 2 atau b akan sama dengan 1 (x2= 1), dan kemudian tekanan stim hanya berhutang b. Suhu ini menjadi titik mendidih b.
Sementara itu, di hujung yang lain (kanan), ketika x2= 0 tetapi x1= 1, tekanan wap hanya. Suhu ini menjadi titik mendidihnya.
Garis bujur yang lebih rendah sepadan dengan titik gelembung, iaitu apabila gelembung pertama muncul apabila campuran cecair dipanaskan (naik rajah). Dan garis atas sepadan dengan titik embun, iaitu ketika fasa stim sejuk dan penurunan pertama muncul (turun dalam rajah).
Azeotropos
Dalam banyak penyelesaian yang tidak ideal kita akan mempunyai azeotrops, yang merupakan campuran yang menguap mengekalkan komposisi mereka tetap; iaitu, mereka menguap seolah -olah mereka adalah sebatian murni.
Tidak mustahil untuk "memecahkan" komposisi azeotropik melalui lebih banyak langkah penyulingan. Sebaliknya, kaedah lain digunakan untuk meningkatkan kesucian komponen yang dikehendaki.
Sebagai contoh, campuran air etanol membentuk azeotropik dengan komposisi 95.4 etanol. Ini bermakna bahawa mustahil, melalui penyulingan, untuk mendapatkan etanol dengan kepekatan lebih besar daripada 95.4%; Selalu akan ada 4.6% baki air. Sekiranya anda ingin menyediakan etanol mutlak (100%), ia dikehendaki menggunakan bahan dehidrasi, atau laluan sintesis lain.
Dalam rajah binari kita dapat melihat kehadiran azeotrope, yang membentangkan bentuk berikut:
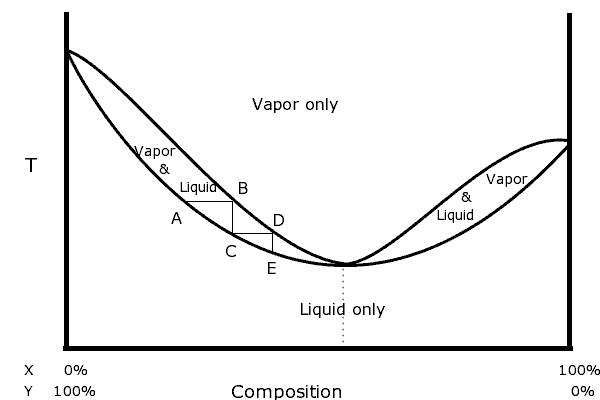 Gambarajah binari campuran dengan azeotropik positif. Sumber: Karlhahn di Bahasa Inggeris Wikipedia, Domain Awam, melalui Wikimedia biasa
Gambarajah binari campuran dengan azeotropik positif. Sumber: Karlhahn di Bahasa Inggeris Wikipedia, Domain Awam, melalui Wikimedia biasa Di sebelah kiri gambarajah, dapat dilihat bahawa dalam "bujur", sebuah rantau di mana kita mempunyai keseimbangan cecair-wap, kita dapat menyuling langkah berturut-turut (a, b, c, d dan e) untuk mendapatkan yang semakin kaya campuran dalam komponen yang paling tidak menentu (x untuk rajah ini).
Di titik azeotropik, bagaimanapun, campuran x dan y dan rebus seolah -olah ia adalah satu bahan, jadi tidak kira berapa banyak penyulingan dibuat, kedua -dua cecair dan stim akan mempunyai komposisi yang sama.
Boleh melayani anda: formula molekul: Cara mengeluarkannya, contoh dan latihanSebahagiannya larut
Dalam campuran sebahagiannya larut mereka akan dibentuk, bergantung pada suhu, dua fasa yang dikenali: satu kaya dengan komponen A, dan satu lagi kaya komponen b. Gambar rajah binari untuk kes -kes ini lebih banyak ketat dan luas, kerana mereka melibatkan kawasan di mana stim bersama bersama dengan dua fasa.
Tidak dapat dilepaskan
Semasa bercakap tentang campuran yang tidak dapat dilepaskan, setiap komponen akan berkelakuan seolah -olah ia berada dalam keadaan kesucian yang tinggi, kerana ia hampir tidak berinteraksi dengan molekul lain. Oleh itu, tekanan stim untuk campuran ini akan sama dengan:
Pmatahari = PKeº + pBº +··· pYoº
Campuran akan mendidih pada suhu yang lebih rendah daripada komponen tulen, kerana tekanan campuran yang tidak dapat dilepaskan akan lebih tinggi, kerana ia sama dengan jumlah tekanan setiap komponen dalam keadaan tulennya. Lebih banyak tekanan stim menunjukkan bahawa ia lebih tidak menentu, dan oleh itu akan mendidih pada suhu yang lebih rendah.
Aplikasi
Penyulingan
Dalam penyulingan, terutamanya di peringkat perindustrian, pengetahuan mengenai keseimbangan wap cecair adalah utama. Dari komponen campuran, dan gambar rajah fasa, dapat dikira berapa banyak hidangan yang diperlukan dalam pembinaan menara fraksionasi untuk pemisahan komponen yang betul.
Penyulingan wap air
Wap air boleh dipam di dalam campuran di bawah penyulingan. Apabila wap air menggelegak di dalam cecair, tekanan stim campuran akan ditingkatkan, jadi ia akan mendidih pada suhu yang lebih rendah dan membantu mengekstrak komponen yang paling tidak menentu (seperti esensi).
Minum burung
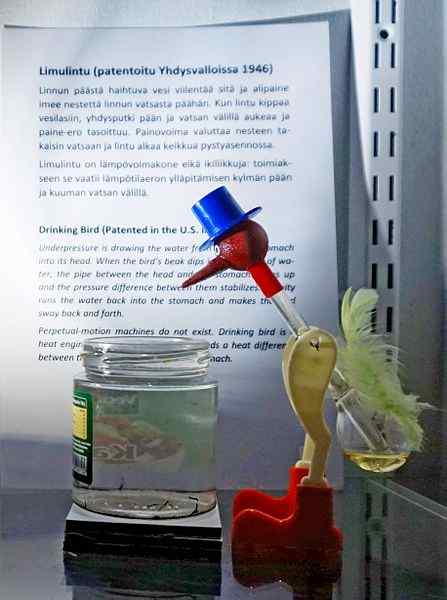 Minum burung, salah satu mainan yang paling bijak sepanjang masa. Sumber: Tiia Monto, CC By-SA 4.0, melalui Wikimedia Commons
Minum burung, salah satu mainan yang paling bijak sepanjang masa. Sumber: Tiia Monto, CC By-SA 4.0, melalui Wikimedia Commons Walaupun tidak tepat keseimbangan wap cecair, kebenarannya adalah di sebalik operasi burung minum beberapa fenomena termodinamik tersembunyi.
Ketika kepala burung basah, ia mula sejuk ketika air menguap. Pengurangan suhu ini menyebabkan penurunan tekanan di dalam kepala burung. Methylene Chloride, yang terletak di pangkal burung, akan berusaha mengimbangi tekanan, mengalir melalui tiub kaca yang menghubungkan kepala dengan kepala.
Cecair akan naik ke kepala burung, menjadikannya lebih berat dan memiringkan badannya ke hadapan. Burung kemudian "minum air" dan tekanan stim akan mengimbangi. Keseimbangan tekanan, burung burung akan kembali ke kedudukan menegak dan kitaran akan diulang sementara air kepala menguap lagi.
Rujukan
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (8th ed.). Pembelajaran Cengage.
- Walter J. Moore. (1962). Kimia Fizikal. (Edisi Keempat). Longmans.
- Wikipedia. (2020). Keseimbangan wap-cecair. Diperoleh dari: dalam.Wikipedia.org
- Ed Vitz et al. (5 November 2020). Keseimbangan wap-cecair. Kimia Librettexts. Pulih dari: chem.Libretxts.org
- Limer Eric. (30 Januari 2018). Penjelasan terperinci mengenai mainan burung minum. Pulih dari: popularmechanics.com
- Universiti Alicante. (s.F.). Topik 4: Pengiraan wap keseimbangan. Gambar rajah keseimbangan. [Pdf]. Pulih dari: rua.Ua.adalah

