Skala Pauling

- 2414
- 25
- Clarence Greenholt DDS
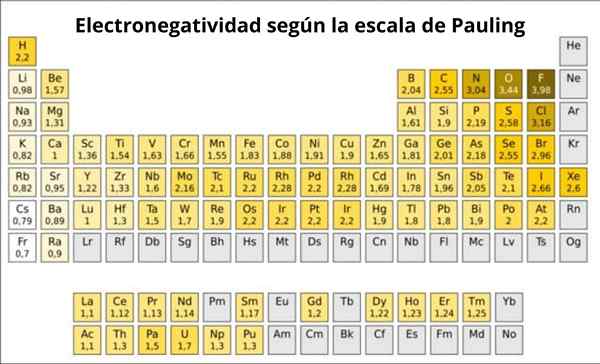 Rajah 1. Skala Pauling. Sumber: Wikimedia Commons.
Rajah 1. Skala Pauling. Sumber: Wikimedia Commons. Apakah skala Pauling?
The Skala Pauling Ia adalah skala sewenang -wenang yang digunakan dalam kimia untuk menyatakan Elektronegativiti unsur -unsur. Ini ditakrifkan sebagai kecenderungan atom tertentu untuk menarik elektron apabila digabungkan dengan atom lain.
Dalam pengertian ini, elemen elektronegativiti yang tinggi cenderung mendapat elektron dengan mudah. Ini adalah bukan logam, sementara bagi mereka, unsur -unsur elektronegatif yang kurang seperti logam, lebih mudah bagi mereka untuk menghasilkan elektron.
Oleh itu, mengetahui elektronegativiti elemen mempunyai idea jenis pautan yang mampu membentuk ketika digabungkan dengan yang lain. Kita akan melihatnya dengan contoh berangka kemudian.
Dengan maklumat ini, anda boleh meramalkan banyak sifat yang akan dimiliki oleh sebatian, sesuatu yang sangat berguna dalam kimia eksperimen dan untuk sains bahan, di mana sebatian novel terus dibuat.
Walau bagaimanapun, adalah mudah untuk menjelaskan bahawa walaupun betapa pentingnya, tidak ada cara yang unik untuk menentukan elektronegativiti; Skala Pauling hanya salah satu daripada pelbagai bentuk yang dicadangkan untuk mencarinya, walaupun ia adalah salah satu yang paling banyak digunakan.
Malah, Pauling adalah skala sewenang -wenang di mana nilai berangka diberikan kepada setiap elemen jadual berkala, yang mencerminkan elektronegativiti. Kami melihatnya dalam Rajah 1, di mana anda mempunyai elektronegativiti setiap elemen, seperti yang diberikan oleh Hadiah Nobel Linus Pauling (1901-1994) sekitar tahun 1939.
Elektronegativiti unsur -unsur
Pauling, bersebelahan dengan Don M. Yost, mendapati nilai elektronegativiti secara empirik, melalui data eksperimen yang diperoleh dengan mengukur tenaga pautan.
Pauling ditugaskan ke fluorin.0. Oleh itu, apabila fluorida membentuk pautan, ia mempamerkan trend tertinggi untuk menarik elektron di antara semua elemen.
Ia boleh melayani anda: Nombor Penyelarasan: Apa, Pengiraan, ContohKedua adalah oksigen, dengan 3.5 dan ketiga adalah nitrogen dengan 3.0. Kedua -duanya terletak di atas dan di sebelah kanan meja.
Sebaliknya, di seberang, elemen elektronegatif paling sedikit adalah cesium, yang simbolnya adalah CS, yang terletak di sebelah kiri meja, yang Pauling memberikan nombor 0.7.
Elektronegativiti dalam jadual berkala
Secara umum dan seperti yang diperhatikan dalam Rajah 1, tenaga elektronegativiti - dan pengionan - meningkat dari kiri ke kanan dalam jadual berkala. Trend umum juga menunjukkan penurunan apabila bergerak dari atas ke bawah.
Oleh itu unsur -unsur elektronegatif yang paling banyak akan memilikinya di sudut kanan atas meja: fluorin, oksigen, klorin, nitrogen. Elektronegatif -atau yang paling elektropositif jika mereka lebih disukai -akan berada di sebelah kiri: litium, natrium, kalium dan unsur -unsur lain dari kumpulan 1 -lajur yang melampau kiri, sepadan dengan logam alkali dan alkali-.
Dalam setiap lajur, elektronegativiti berkurangan dengan meningkatkan bilangan atom elemen, kecuali dalam logam peralihan di tengah, yang tidak mengikuti trend ini.
Satu perkara penting untuk menyerlahkan adalah bahawa elektronegativiti adalah relatif, ia bukan harta yang tidak dapat dilupakan bagi setiap elemen, dan hanya diukur berkenaan dengan unsur -unsur lain. Ia banyak bergantung pada keadaan pengoksidaan, jadi elemen yang sama dapat mempamerkan elektronegativiti yang berbeza, bergantung pada jenis kompaun yang membentuk.
Perbezaan tenaga pautan
 Rajah 2. Ahli kimia Amerika Linus Pauling pada tahun 1955. Sumber: Wikimedia Commons.
Rajah 2. Ahli kimia Amerika Linus Pauling pada tahun 1955. Sumber: Wikimedia Commons. Dalam kimia, pautan adalah cara di mana atom disatukan, sama atau berbeza, untuk membentuk molekul. Antara atom adalah kekuatan yang membuat mereka bersama stabil.
Terdapat beberapa jenis pautan, tetapi dua dianggap di sini:
- Kovalen, di mana atom elektronegativiti yang serupa berkongsi beberapa elektron.
- Ionik, kerap antara atom dengan elektronegativiti yang berbeza di mana tarikan elektrostatik berlaku.
Katakan dua elemen A e b boleh membentuk molekul antara satu sama lain, dilambangkan AA dan BB. Dan mereka juga dapat bergabung untuk membentuk sebatian ab, semuanya melalui beberapa jenis pautan.
Terima kasih kepada penyertaan kekuatan intermolecular, ada tenaga dalam pautan. Contohnya tenaga dalam pautan AA adalah eAa, Dalam pautan BB adalah suram dan akhirnya di Compound AB adalah EAb.
Sekiranya molekul ab akan dibentuk oleh ikatan kovalen, secara teorinya, tenaga pautan adalah purata tenaga danAa dan eBb:
DanAb = ½ (eAa + DanBb)
Pauling dikira eAb Untuk beberapa sebatian, ia mengukurnya secara eksperimen dan menentukan perbezaan antara kedua -dua nilai, yang dipanggil δ:
Δ = | (eAb) diukur - (eAb) Teoritis | = | (EAb) diukur - ½ (eAa + DanBb) |
Pauling beralasan seperti ini: jika δ sangat dekat dengan 0, ini bermakna bahawa elektronegativiti kedua -dua elemen adalah serupa dan pautan yang menyatukan mereka adalah kovalen. Tetapi jika δ tidak kecil, maka hubungan antara a dan b bukan kovalen tulen.
Semakin besar nilai mutlak δ, semakin besar perbezaan antara elektronegativiti unsur -unsur a dan b dan oleh itu pautan yang tidak akan menjadi jenis ionik. Kemudian pembaca akan menemui contoh di mana, mengira δ, adalah mungkin untuk menentukan jenis pautan sebatian.
Persamaan untuk elektronegativiti
Bermula dari fakta bahawa perbezaan tenaga adalah isyarat yang membezakan sifat pautan, Pauling melakukan banyak eksperimen yang menyebabkannya membuat ekspresi empirikal untuk elektronegativiti relatif dua elemen untuk e b yang membentuk molekul.
Dengan menandakan elektronegativiti seperti χ (huruf Yunani "chi"), Pauling ditakrifkan δ seperti berikut:
F2· Δ = [χ (A) - χ (B)]2
χ (A) - χ (B) = F√δ = 0.102√δ
Boleh melayani anda: keseimbangan tanteo: langkah, contoh dan latihanPerhatikan bahawa δ adalah jumlah positif. Fatia F = 0.102 yang muncul mengalikan akar kuadrat δ adalah faktor penukaran antara KJ (kilojoules) dan EV (elektron-volt), kedua-dua unit tenaga.
Jika sebaliknya kilocalorories dan volt elektron digunakan, perbezaan elektronegativiti dinyatakan dengan formula yang sama tetapi dengan f = 0.208:
χ (A) - χ (B) = 0.208 dinding
Pauling mula memberikan hidrogen nilai 2.1, nilai sebelumnya yang diperoleh oleh ahli kimia Robert Mulliken. Dia memilih elemen ini sebagai titik permulaan kerana ia membentuk hubungan kovalen dengan banyak yang lain.
Melalui persamaan sebelumnya, beliau terus memberikan nilai yang berkaitan dengan unsur -unsur yang lain. Ia menyedari bahawa elektronegativiti meningkat apabila ia bergerak dari kiri ke kanan dan dari atas ke bawah dalam jadual berkala, seperti yang diterangkan dalam bahagian sebelumnya.
Contoh
Berikut adalah senarai elemen: n, j, dan m dan elektronegativiti masing -masing χ mengikut skala Pauling:
-N: Χ = 4.0
-J: Χ = 1.5
-Dan: Χ = 0.9
-M: Χ = 1.6
Antara sebatian berikut yang terbentuk dengan mereka:
YJ, YN, MN dan JM
Tunjukkan yang mempunyai watak ionik terbesar dan sifatnya yang kovalen. Alasan jawapan anda.
Penyelesaian
Menurut kriteria yang ditubuhkan oleh Pauling, kompaun dengan watak ionik tertinggi akan menjadi perbezaan yang paling besar antara elektronegativiti, dan oleh itu nilai yang lebih besar δ. Bagi bahagiannya, kompaun dengan perbezaan tenaga terendah adalah yang mempunyai ikatan kovalen.
Kemudian kita akan mengira berapa banyak δ bernilai untuk setiap kompaun, seperti berikut:
Kompaun yj
Δ = [χ (y) - χ (j)]2 = (0.9 - 1.5)2 = 0.36
YN COMPOUND
Δ = [χ (y) - χ (n)]]2 = (0.9 - 4.0)2 = 9.61
Kompaun Mn
Δ = [χ (m) - χ (n)]2 = (1.6 - 4.0)2 = 5.76
Kompaun JM
Δ = [χ (j) - χ (m)]2 = (1.5 - 1.6)2 = 0.01
Dari hasil di atas, ia mengikuti bahawa kompaun watak ionik adalah Yn, yang δ = 9.61, manakala kompaun watak kovalen adalah JM, dengan δ = 0.01.

