Sifat skala mikroskopik, mengira zarah, contoh
- 2325
- 732
- Mr. Tracy Parisian
The Skala mikroskopik Ia adalah satu yang digunakan untuk mengukur saiz dan panjang yang tidak dapat dilihat dengan mata kasar dan yang berada di bawah milimeter panjangnya. Dari yang lebih tinggi hingga terendah, skala mikroskopik dalam sistem metrik adalah:
- Milimeter (1 mm), yang sepersepuluh sentimeter atau seribu satu meter. Di dalamnya, skala kita mempunyai salah satu sel terbesar di dalam badan, yang merupakan ovule, yang saiznya 1.5mm.
 Rajah 1. Sel darah merah adalah sel skala mikroskopik. Sumber: Pixabay
Rajah 1. Sel darah merah adalah sel skala mikroskopik. Sumber: Pixabay - Sepersepuluh milimeter (0.1 mm). Ini adalah skala ketebalan atau diameter rambut manusia.
- Mikrometer atau micra (1μm = 0.001mm). Pada skala ini adalah sel tumbuhan dan haiwan dan bakteria.
Sel tumbuhan adalah urutan 100μm. Sel -sel haiwan adalah sepuluh kali kecil, ia adalah perintah 10μm; Walaupun bakteria 10 kali kurang daripada sel haiwan dan urutan 1μm.
[TOC]
Skala nanometrik
Terdapat langkah -langkah yang lebih kecil daripada skala mikroskopik, tetapi biasanya tidak digunakan kecuali dalam beberapa konteks khas. Seterusnya kita akan melihat beberapa langkah nanometrik yang paling penting:
- Nanometer (1 ηm = 0.001 μm = 0.000001 mm) adalah juta milimeter. Pada skala ini terdapat beberapa virus dan molekul. Virus adalah perintah 10 ηm dan molekul urutan 1ηm.
- Angstrom (1Å = 0.1 ηm = 0.0001μm = 10-7mm). Ukuran ini membentuk skala atau saiz atom.
- Fantometer (1FM = 0.00001å = 0.000001 ηm = 10-12mm). Ini adalah skala nukleus atom, yang antara 10 ribu hingga 100 ribu kali lebih kecil daripada atom. Walau bagaimanapun, walaupun saiznya yang kecil, nukleus menumpukan 99.99% daripada jisim atom.
- Terdapat skala yang lebih kecil kepada nukleus atom, kerana ini terdiri daripada zarah seperti proton dan neutron. Tetapi ada lebih banyak lagi: zarah -zarah ini pada gilirannya dibentuk oleh zarah -zarah yang lebih asas seperti kuark.
Instrumen untuk pemerhatian mikroskopik
Apabila objek antara milimeter dan skala mikrometrik (1 mm - 0.001mm), mereka dapat diperhatikan dengan mikroskop optik.
Walau bagaimanapun, jika objek atau struktur antara nanometer dan angstrom, maka mikroskop elektronik atau nanoskop diperlukan.
Dalam mikroskopi elektronik dan bukannya elektron tenaga tinggi yang digunakan yang mempunyai panjang gelombang yang lebih rendah daripada cahaya. Kelemahan mikroskop elektronik adalah tidak mungkin.
Boleh melayani anda: kejutan magnet: unit, formula, pengiraan, contohSebaliknya, cahaya laser digunakan dalam nanoskop, dan ia mempunyai kelebihan ke atas mikroskopi elektronik bahawa struktur dan molekul dapat dilihat dan direkodkan di dalam sel hidup.
Nanoteknologi adalah teknologi yang mana litar, struktur, bahagian dan juga enjin dihasilkan pada skala dari nanometer ke skala atom.
Sifat mikroskopik
Dalam fizik, dalam pendekatan pertama tingkah laku bahan dan sistem dikaji dari sudut pandangan makroskopik. Dari paradigma ini, perkara itu adalah kontinum yang tidak dapat dibahagikan; Dan pandangan ini sah dan mencukupi untuk banyak situasi kehidupan seharian.
Walau bagaimanapun, beberapa fenomena dunia makroskopik hanya mempunyai penjelasan jika sifat mikroskopik perkara itu diambil kira.
Di sudut pandangan mikroskopik, struktur molekul dan atom perkara itu diambil kira. Tidak seperti pendekatan makroskopik, pada skala ini terdapat struktur berbutir dengan lubang dan ruang antara molekul, atom dan bahkan di dalamnya.
Ciri -ciri lain dari sudut pandangan mikroskopik dalam fizik, adalah bahawa sekeping perkara tidak kira betapa kecilnya, terdiri daripada sejumlah besar zarah yang dipisahkan antara satu sama lain dan dalam pergerakan berterusan.
-Perkara adalah kekosongan yang sangat besar
Dalam pai kecil.
Ia. Dalam pengertian ini, skala mikroskopik mempunyai persamaan dengan skala astronomi.
Objek makroskopik kepada penemuan atom
Bahan kimia pertama, yang merupakan alkimia, menyedari bahawa bahan -bahan itu boleh menjadi dua jenis: murni atau sebatian. Ini mencapai idea unsur -unsur kimia.
Ia dapat melayani anda: kecerunan tekanan: Apa itu dan bagaimana ia dikiraUnsur -unsur kimia pertama yang ditemui ialah tujuh logam zaman dahulu: perak, emas, besi, plumbum, timah, tembaga dan merkuri. Dari masa ke masa mereka ditemui lebih banyak setakat bahan -bahan yang dijumpai yang tidak dapat diuraikan di yang lain.
Kemudian unsur -unsur diklasifikasikan mengikut sifat dan ciri -ciri mereka dalam logam dan bukan logam. Semua yang mempunyai sifat kimia dan pertalian yang serupa.
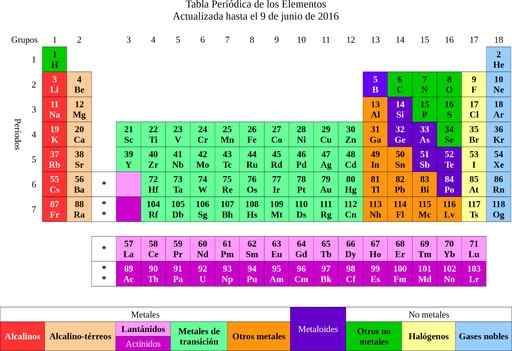 Rajah 2. Jadual Elemen Berkala. Sumber: Wikimedia Commons.
Rajah 2. Jadual Elemen Berkala. Sumber: Wikimedia Commons. Dari unsur -unsur ia pergi ke idea atom, perkataan yang bermaksud tidak dapat dipisahkan. Tidak lama kemudian para saintis menyedari bahawa atom mempunyai struktur. Di samping itu atom mempunyai dua jenis caj elektrik (positif dan negatif).
Zarah subatomi
Dalam eksperimen Rutherford di mana dia mengebom atom plat emas nipis dengan zarah alfa, struktur atom diturunkan: nukleus positif kecil yang dikelilingi oleh elektron.
Mereka terus membombardir atom -atom zarah tenaga yang semakin banyak dan masih dilakukan, untuk membongkar rahsia dan sifat dunia mikroskopik semakin kecil pada skala yang lebih kecil.
Dengan cara ini, model standard telah dicapai, yang menetapkan bahawa zarah -zarah asas yang benar adalah yang mana atom -atom terdiri. Sebaliknya, atom menimbulkan unsur -unsur, ini kepada sebatian dan semua interaksi yang diketahui (kecuali graviti). Secara keseluruhan terdapat 12 zarah.
Zarah -zarah asas ini juga mempunyai jadual berkala mereka. Terdapat dua kumpulan: zarah fermionik spin ½ dan bosonik. Bosonik bertanggungjawab untuk interaksi. Fermionik adalah 12 dan adalah yang menimbulkan proton, neutron dan atom.
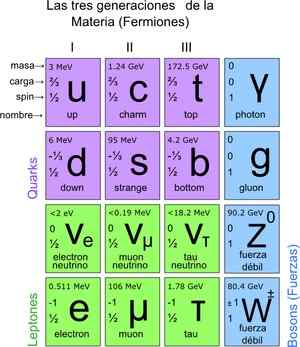 Rajah 3. Zarah asas. Sumber: Wikimedia Commons.
Rajah 3. Zarah asas. Sumber: Wikimedia Commons. Cara mengira zarah pada skala mikroskopik?
Dari masa ke masa ahli kimia menemui jisim relatif unsur -unsur dari pengukuran yang tepat dalam reaksi kimia. Sebagai contoh, dapat ditentukan bahawa karbon adalah 12 kali lebih berat daripada hidrogen.
Ia juga ditentukan bahawa hidrogen adalah elemen paling ringan, sehingga elemen ini diberikan jisim relatif 1.
Sebaliknya, bahan kimia diperlukan untuk mengetahui bilangan zarah yang terlibat dalam tindak balas, sehingga tidak ada reagen yang hilang. Contohnya molekul air memerlukan dua atom hidrogen dan satu oksigen.
Dapat melayani anda: fenomena bergeloraDari latar belakang ini konsep mol dilahirkan. Satu mol dari mana -mana bahan adalah jumlah tetap zarah yang bersamaan dengan jisim molekul atau atomnya dalam gram. Oleh itu, ditentukan bahawa 12 gram karbon mempunyai bilangan zarah yang sama seperti 1 gram hidrogen. Nombor itu dikenali sebagai nombor avogadro: 6.02 x 10^23 zarah.
-Contoh 1
Kirakan berapa banyak atom emas dalam 1 gram emas.
Penyelesaian
Diketahui bahawa emas mempunyai berat atom 197. Data ini boleh didapati dalam jadual berkala dan menunjukkan bahawa atom emas adalah 197 kali lebih berat daripada satu hidrogen dan 197/12 = 16,416 kali lebih berat daripada karbon.
Mol emas mempunyai atom 6.02 × 10^23 dan mempunyai berat atom yang dinyatakan dalam gram, iaitu 197 gram.
Dalam gram emas terdapat 1/197 tahi lalat emas, iaitu 6.02 × 10^23átomos/197 = 3.06 x10^23 atom emas.
-Contoh 2
Tentukan bilangan molekul kalsium karbonat (CACO3) bahawa terdapat dalam 150 gram bahan ini. Juga katakan berapa banyak atom kalsium, berapa banyak karbon dan berapa banyak oksigen yang ada di kawasan ini.
Penyelesaian
Perkara pertama ialah menentukan jisim molekul kalsium karbonat. Jadual berkala menunjukkan bahawa kalsium mempunyai berat molekul 40 g/mol, karbon 12 g/mol dan oksigen 16 g/mol.
Kemudian jisim molekul (Caco3) menjadi:
40 g/mol + 12 g/mol + 3 x 16 g/mol = 100 g/mol
Setiap 100 gram kalsium karbonat adalah 1mol. Kemudian dalam 150 gram sesuai dengan 1.5 mol.
Setiap mol karbonat mempunyai molekul 6.02 x 10^23 karbonat, jadi dalam 1.5 mol karbonat terdapat 9.03 x 10^23 molekul.
Meringkaskan, dalam 150 gram kalsium karbonat terdapat:
- 9.03 x 10^23 Molekul Kalsium Karbonat.
- Atom kalsium: 9.03 x 10^23 .
- Juga 9.03 x 10^23 atom karbon
- Akhirnya, 3 x 9.03 x 10^23 atom oksigen = 27.09 x 10^23 atom oksigen.
Rujukan
- Biologi Gunaan. Apakah langkah mikroskopik?. Pulih dari: youtube.com
- Pendidikan Kimia. Perwakilan makroskopik, submikroskopik dan simbolik mengenai perkara. Pulih dari: Scielo.org.mx.
- Garcia a. Kursus Fizik Interaktif. Makro -state, microstates. Suhu, entropi. Diperolehi dari: sc.Ehu.adalah
- Struktur mikroskopik bahan. Pulih dari: alipso.com
- Wikipedia. Tahap mikroskopik. Pulih dari: wikipedia.com

