Spektrum penyerapan

- 2841
- 617
- Clarence Greenholt DDS
 Spektrum cahaya yang kelihatan. Sumber: Wikimedia Commons
Spektrum cahaya yang kelihatan. Sumber: Wikimedia Commons Apakah spektrum penyerapan?
A Spektrum penyerapan Ia adalah hasil interaksi cahaya dengan bahan atau bahan di mana -mana keadaan fizikalnya. Interaksi ini merangkumi segmen luas pelbagai panjang gelombang dan tenaga radiasi elektromagnet.
Dalam erti kata lain, spektrum penyerapan mencerminkan bahawa pecahan sinaran elektromagnetik yang bahan tertentu menyerap dalam julat kekerapan.
Dalam pengertian ini, beberapa pepejal, cecair atau gas dapat menyerap foton tenaga atau panjang gelombang yang berbeza, dari radiasi ultraviolet, diikuti dengan cahaya yang kelihatan, radiasi atau cahaya inframerah, mengejutkan dalam gelombang gelombang mikro panjang gelombang panjang gelombang mikro.
Mata manusia hanya melihat interaksi perkara dengan cahaya yang kelihatan. Ia juga dapat merenungkan difraksi cahaya putih melalui prisma atau medium dalam komponen berwarna -warni (imej unggul).
Sekiranya sinar cahaya "menangkap" setelah mengembara melalui bahan, dan dianalisis, ketiadaan jalur berwarna tertentu akan dijumpai. Iaitu, jalur hitam akan diperhatikan berbeza dengan latar belakangnya.
Ini adalah spektrum penyerapan, dan analisisnya adalah asas dalam kimia analitik dan astronomi instrumental.
Penyerapan atom
Di bahagian atas, spektrum penyerapan biasa unsur -unsur atau atom ditunjukkan. Perhatikan bahawa jalur hitam mewakili panjang gelombang yang diserap, sementara yang lain dipancarkan. Ini bermaksud, sebaliknya, spektrum siaran atom akan kelihatan seperti band hitam dengan warna yang dipancarkan.
Tetapi apakah jalur itu? Cara Mengetahui Jika Atom menyerap atau memancarkan (tanpa memperkenalkan pendarfluor atau pendarahan)? Jawapannya ada di negara elektronik yang dibenarkan oleh atom.
Boleh melayani anda: formula minimum: Cara mendapatkan formula minimum, contoh dan latihanPeralihan dan tenaga elektronik
Elektron dapat bergerak dari nukleus, meninggalkannya secara positif semasa perjalanan dari orbital tenaga yang lebih rendah ke salah satu tenaga yang lebih besar. Untuk melakukan ini, dijelaskan oleh fizik kuantum, menyerap foton tenaga tertentu untuk melaksanakan peralihan elektronik tersebut.
Oleh itu, tenaga dikira, dan tidak akan menyerap medium atau tiga suku foton, tetapi nilai frekuensi (ν) atau panjang gelombang konkrit (λ).
Setelah elektron teruja, ia tidak tetap tidak terbatas dalam keadaan elektronik tenaga yang lebih besar. Melepaskan tenaga dalam bentuk foton, dan atom kembali ke keadaan basal atau asalnya.
Bergantung pada sama ada foton yang diserap direkodkan, akan ada spektrum penyerapan. Dan jika foton yang dikeluarkan direkodkan, maka hasilnya akan menjadi spektrum pelepasan.
Fenomena ini dapat dilihat secara eksperimen jika sampel lembut atau atomisasi dipanaskan dari elemen. Dalam astronomi, membandingkan spektrum ini, komposisi bintang dapat diketahui, dan bahkan lokasinya yang berkaitan dengan bumi.
Spektrum yang kelihatan
Seperti yang dapat dilihat dalam imej, spektrum yang kelihatan termasuk warna dari violet ke merah dan semua warna berkenaan dengan berapa banyak bahan yang menyerap (nuansa gelap).
Panjang gelombang lampu merah sesuai dengan nilai 650 nm dan seterusnya (sehingga hilang dalam radiasi inframerah).
Dan di sebelah kiri, nada ungu dan ungu meliputi nilai panjang gelombang sehingga 450 nm. Spektrum yang kelihatan kemudian meliputi dari 400 hingga kira -kira 700 nm.
Apabila λ meningkat, kekerapan foton berkurangan, dan, oleh itu, tenaga. Oleh itu, cahaya violet mempunyai tenaga yang lebih besar (panjang gelombang yang lebih rendah) daripada cahaya merah (panjang gelombang yang lebih tinggi).
Boleh melayani anda: bromin: sejarah, struktur, konfigurasi elektronik, sifat, kegunaanOleh itu, bahan yang menyerap cahaya ungu membayangkan peralihan elektronik tenaga yang lebih besar.
Apabila bahan menyerap warna ungu, ia akan memakai warna kuning kehijauan, yang bermaksud bahawa elektronnya melakukan peralihan tenaga yang sangat. Dan apabila bahan menyerap warna merah, kurang tenaga, ia akan mencerminkan warna hijau kebiruan.
Apabila atom sangat stabil, ia biasanya membentangkan keadaan elektronik yang sangat jauh dalam tenaga, dan dengan itu perlu menyerap foton tenaga yang lebih besar untuk membolehkan peralihan elektronik:
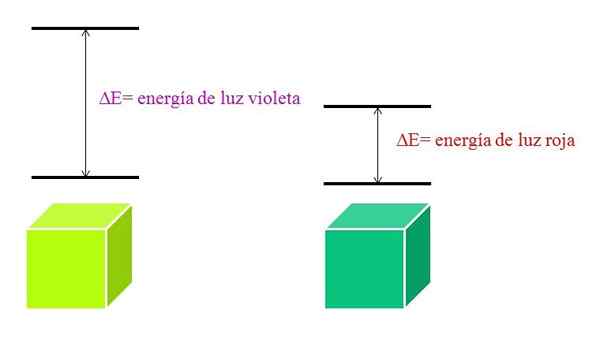 Skim tenaga cahaya ungu dan cahaya merah. Sumber: Gabriel Bolívar
Skim tenaga cahaya ungu dan cahaya merah. Sumber: Gabriel Bolívar Spektrum penyerapan molekul
Molekul mempunyai atom, dan ini juga menyerap radiasi elektromagnet. Walau bagaimanapun, elektron mereka adalah sebahagian daripada ikatan kimia, jadi peralihan mereka berbeza. Salah satu kejayaan besar teori orbit molekul adalah dapat mengaitkan spektrum penyerapan dengan struktur kimia.
Oleh itu, pautan mudah, berganda, tiga, konjugasi, dan struktur aromatik, mempunyai keadaan elektronik mereka sendiri, menyerap foton yang sangat spesifik.
Dengan memiliki beberapa atom, sebagai tambahan kepada interaksi intermolecular dan getaran pautan mereka (yang juga menyerap tenaga), spektrum penyerapan molekul mempunyai bentuk "gunung", yang menunjukkan band -band yang termasuk panjang gelombang di mana peralihan elektronik.
Terima kasih kepada spektrum ini, sebatian boleh dicirikan, mengenal pasti, dan bahkan melalui analisis multivariate, mengukurnya.
Metilena biru
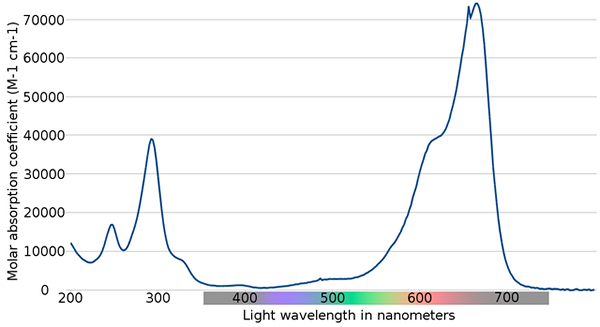 Spektrum biru metilena. Sumber: Wikimedia Commons
Spektrum biru metilena. Sumber: Wikimedia Commons Di bahagian atas, spektrum penunjuk metilena biru ditunjukkan. Seperti namanya, ia berwarna biru, tetapi boleh diperiksa dengan spektrum penyerapannya?
Boleh melayani anda: perubahan fizikalPerhatikan bahawa terdapat band antara panjang gelombang 200 dan 300 nm. Antara 400 dan 500 nm hampir tidak ada penyerapan, iaitu, ia tidak menyerap warna ungu, biru atau hijau.
Walau bagaimanapun, ia membentangkan band penyerapan sengit selepas 600 nm, dan, oleh itu, mempunyai peralihan elektronik yang rendah yang menyerap foton cahaya merah.
Oleh itu, dan diberi nilai tinggi penyerapan molar, metilena biru mempamerkan warna biru yang sengit.
Chlorophiles a dan b
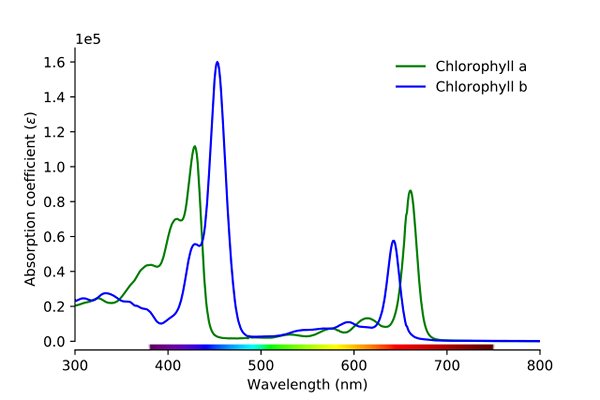 Spektrum penyerapan klorofil a dan b. Sumber: Wikimedia Commons
Spektrum penyerapan klorofil a dan b. Sumber: Wikimedia Commons Seperti yang dapat dilihat dalam imej, garis hijau sepadan dengan klorofil spektrum penyerapan, manakala garis biru sepadan dengan klorofil b.
Pertama, band di mana penyerapan molar lebih tinggi, dalam kes ini, yang berada di sebelah kiri, antara 400 dan 500 nm. Klorofil dengan warna ungu yang sangat menyerap, sementara klorofil b (garis biru) melakukannya dengan warna biru.
Dengan menyerap klorofil b sekitar 460 nm (biru), warna kuning dicerminkan. Sebaliknya, ia juga menyerap dengan kuat, kira -kira 650 nm, cahaya oren, yang bermaksud ia mempamerkan warna biru. Sekiranya kuning dan biru bercampur, ia menghasilkan warna hijau.
Dan akhirnya, klorofil menyerap warna violet kebiruan, dan juga, lampu merah sekitar 660 nm. Oleh itu, ia mempamerkan warna "lembut" hijau dengan kuning.
Rujukan
- Observatoire de Paris (s.F.). Pelbagai jenis spektrum. Diperoleh secara purata4.Osppm.fr
- Kampus Universiti Ranals (s.F.). Spektrofometri: Spektrum Penyerapan dan Kuantiti Colorimetric Biomolekul. UCO pulih.adalah

