Formula Minimum Cara Menghapus Formula, Contoh dan Latihan Minimum
- 4543
- 224
- Anthony Breitenberg
The Formula minimum atau empirikal Ini adalah ungkapan perkadaran di mana atom -atom unsur -unsur yang berbeza yang membentuk sebatian kimia hadir. Oleh itu, formula minimum adalah perwakilan paling mudah dari sebatian kimia. Ini disebabkan oleh 'minimum'.
Formula minimum tidak menyatakan nombor atom unsur -unsur yang berbeza yang membentuk sebatian kimia; tetapi perkadaran di mana atom -atom ini digabungkan untuk menghasilkan sebatian kimia.
 Formula minimum ini hampir tidak mendedahkan bahawa sebatian mempunyai jumlah atom karbon dan oksigen yang sama, dan atom hidrogen berganda. Sumber: Gabriel Bolívar.
Formula minimum ini hampir tidak mendedahkan bahawa sebatian mempunyai jumlah atom karbon dan oksigen yang sama, dan atom hidrogen berganda. Sumber: Gabriel Bolívar. Formula minimum juga dipanggil formula empirikal, kerana ia diperolehi daripada percubaan; iaitu, ia berkaitan dengan pengalaman. Pemerhatian eksperimen dibenarkan untuk menyimpulkan bahawa dua atom hidrogen digabungkan dengan atom hidrogen untuk membentuk air (h2Sama ada).
Dalam banyak kes, formula minimum bertepatan dengan formula molekul. Dalam molekul, bilangan sebenar unsur -unsur yang berbeza yang membentuk sebatian kimia muncul; Begitu juga, contohnya, asid sulfurik (h2SW4).
Tetapi dalam kes lain, tidak ada kebetulan formula minimum dan formula molekul; Ini adalah kes benzena: formula minimum adalah ch, manakala formula molekulnya adalah c6H6.
[TOC]
Cara mendapatkan formula minimum?
Langkah pertama
Cari gram setiap elemen yang terdapat di kawasan tersebut. Seperti yang biasanya dinyatakan sebagai peratusan jisim kompaun, pengiraan mudah mesti dibuat untuk transformasi peratusan massa jisim unsur -unsur.
Langkah kedua
Bilangan relatif atom unsur -unsur yang berbeza yang membentuk sebatian kimia diperolehi. Untuk melakukan ini, jisim setiap elemen dibahagikan, dinyatakan dalam gram, antara jisim atomnya.
Sebilangan penulis lebih suka memanggil bilangan atom relatif, seperti bilangan tahi lalat atom unsur -unsur yang merupakan sebahagian daripada sebatian kimia.
Boleh melayani anda: butanal: struktur, sifat, kegunaan dan risikoLangkah ketiga
Memperoleh bahagian minimum, yang dinyatakan dalam jumlah keseluruhan, dari setiap atom yang terdapat di dalam sebatian kimia.
Untuk mencari nilai -nilai ini, bilangan relatif setiap atom yang terdapat dalam sebatian antara nilai berangka relatif bahawa atom dalam sebatian kimia dibahagikan.
Sekiranya nilai bahagian minimum atom bukanlah integer tanpa perpuluhan, semua nilai perkadaran minimum oleh nombor mesti didarabkan; Dengan cara ini, ia membolehkan semua nilai bahagian minimum menjadi nombor keseluruhan.
Sebagai contoh, jika nilai bahagian minimum atom sebatian kimia ialah 2.5, mesti didarab semua Nilai bahagian minimum setiap atom yang hadir oleh 2. Oleh itu, semua nilai bahagian minimum hanya akan menjadi nombor keseluruhan.
Langkah keempat
Tulis formula kompaun minimum. Nilai perkadaran minimum bagi atom -atom unsur -unsur yang berbeza akan diletakkan sebagai subskrip simbol kimia unsur -unsur untuk menulis formula minimum.
Contoh formula minimum
Air dan karbon dioksida
Sebilangan besar sebatian kimia mempunyai formula yang, pada masa yang sama, formula minimum dan molekul. Oleh itu, formula air (h2O) adalah formula minimum; Tetapi ia juga merupakan formula molekul. Begitu juga untuk formula karbon dioksida (CO2).
Oksida asas dan asid
Oksida asas dan asid adalah sebatian kimia yang mempunyai formula kimia, melainkan kecuali pengecualian yang kedua -dua formula minimum dan molekul. Keadaan yang sama berlaku dengan hidroksida dan asid, kecuali beberapa asid karboksilik.
Boleh melayani anda: Acetonitrile (C2H3N)Asid asetik
Asid karboksilik yang mempunyai bilangan atom karbon dalam komposisi mereka, secara berasingan, formula minimum dan formula molekul. Asid asetik, sebagai contoh, mempunyai formula molekul (c2H4Sama ada2); Tetapi ia juga membentangkan formula minimum (CHO2Sama ada).
Asid butyric
Asid butyric juga mempunyai formula molekul (c4H8Sama ada2) dan formula minimum (c2H4Sama ada).
Etilena glikol
Sebatian organik lain mempunyai dua jenis formula kimia; Ini adalah kes etilena glikol, yang mempunyai formula molekul (c2H6Sama ada2) dan formula minimum (CHO3Sama ada).
Benzena
Benzene, sebatian aromatik, mempunyai formula molekul (c6H6) dan formula minimum (CH).
Glukosa
Glukosa mempunyai formula molekul (c6H12Sama ada6) dan formula minimum (CHO2Sama ada).
Latihan yang diselesaikan
- Latihan 1
Ethylene Glycol adalah sebatian yang digunakan sebagai antibeku, mempunyai berat molekul 62.1 g/mol dan komposisi peratusan jisim seterusnya:
C: 38 %,
H: 9.7 %
O: 51.16 %.
Langkah pertama
Menyatakan peratusan massa unsur -unsur dalam massa mereka dalam gram. Untuk melakukan ini, berat molekul etilenglicol diambil sebagai rujukan. Sekiranya ini adalah 62.1 gram setiap mol, 38% daripada yang sama terdiri daripada karbon. Dan sebagainya dengan unsur -unsur lain:
Jisim karbon = 62.1 g · (38/100)
= 23.6 g
Jisim hidrogen = 62.1 g · (9.7/100)
= 6,024 g
Jisim oksigen = 62.1 g · (51,16/100)
= 31.77 g
Langkah kedua
Kirakan bilangan relatif setiap atom sekarang (NRA) atau bilangan tahi lalat setiap atom. Untuk melakukan ini, jisim setiap elemen kimia dibahagikan dengan jisim atomnya.
NRA (c) = 23.6 g / 12 g
= 1.97
Ia boleh dibundarkan kepada 2.
NRA (H) = 6,024 g / 1 g
= 6,024
Ia boleh dibundarkan pada 6.
NRA (O) = 31.77 g /16 g
= 1,985
Ia boleh dibundarkan kepada 2.
Langkah ketiga
Kirakan bahagian minimum keseluruhan bilangan unsur -unsur sebatian (PMNE). Untuk melakukan ini, setiap nilai nombor relatif atom (NRA) dibahagikan dengan nilai terendah ini. Dalam kes ini, 2.
Ia dapat melayani anda: asid propanaPMNE (c) = 2/2
= 1
PMNE (H) = 6/2
= 3
PMNE (O) = 2/2
= 1
Langkah keempat
Tulis formula minimum etilena glikol:
Ch3Sama ada
Seperti yang dapat dilihat, nilai -nilai yang diperolehi dalam langkah 3 adalah subskrip elemen kompaun.
- Latihan 2
Asid asetik mempunyai berat molekul 60 g/mol dan komposisi peratusan massa berikut:
C: 40 %
H: 6.67 %
O: 53.33 %
Dapatkan formula kompaun minimum.
Langkah pertama
Mengubah peratusan massa unsur -unsur ke dalam massa mereka yang dinyatakan dalam gram:
Jisim karbon = 60 g · (40/100)
= 24 g
Jisim hidrogen = 60 g · (6,67/100)
= 4 g
Jisim oksigen = 60 g · (53.33/100)
= 32 g
Langkah kedua
Kirakan bilangan relatif atom (NRA) kompaun. Untuk melakukan ini, massa unsur dibahagikan antara massa atom mereka:
NRA (c) = 24 g / 12 g
= 2
NRA (H) = 4 g / 1 g
= 4
NRA (O) = 32 g / 16 g
= 2
Langkah ketiga
Dapatkan bahagian minimum jumlah unsur -unsur sebatian (PMNE). Untuk melakukan ini, nilai NRA unsur -unsur dibahagikan antara nilai NRA yang lebih rendah yang membentangkan elemen:
PMNE (c) = 2/2
= 1
PMNE (H) = 4/2
= 2
PMNE (O) = 2/2
= 1
Langkah keempat
Tulis formula minimum asid asetik:
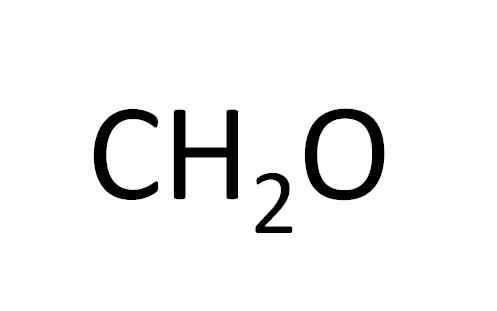
Ch2Sama ada
Subskrip sebatian adalah nilai yang diperoleh dari PMNE.
Rujukan
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (8th ed.). Pembelajaran Cengage.
- Helmestine, Anne Marie, Ph.D. (27 Ogos 2019). Formula empirikal: definisi dan contoh. Pulih dari: Thoughtco.com
- Wikipedia. (2020). Formula empirikal. Diperoleh dari: dalam.Wikipedia.org
- Kimia Librettexts. (3 Julai 2019). Formula mengira empirikal untuk sebatian. Pulih dari: chem.Libretxts.org
- Nicola McDougal. (2020). Formula empirikal: definisi, langkah & contoh. Kajian. Pulih dari: belajar.com
- « Ciri -ciri dan contoh tindak balas yang tidak dapat dipulihkan
- Formula Molekul Cara mengeluarkannya, contoh dan latihan »

