Kuasa intermolecular
- 2778
- 610
- Clarence Greenholt DDS
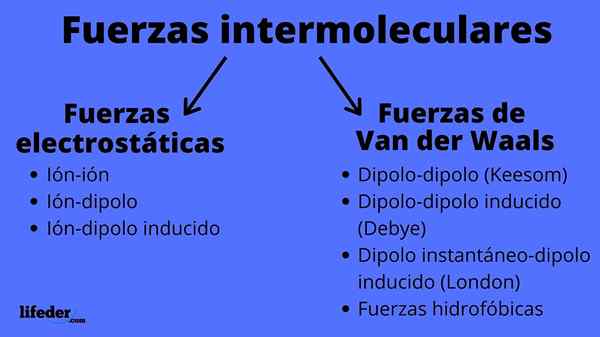
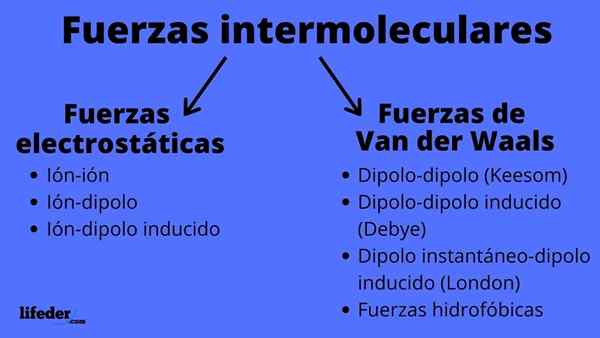 Skim jenis daya intermolecular
Skim jenis daya intermolecular Apakah daya intermolecular?
The Kuasa intermolecular Mereka adalah satu set interaksi yang berlaku di antara molekul, sama ada dari sebatian kimia yang sama atau tidak, dan yang menyatukannya. Terima kasih kepada pasukan molekul ini menguruskan kumpulan dan menentukan pepejal, cecair atau gas; iaitu, mereka bertanggungjawab terhadap sifat fizikal bahan.
Daya intermolecular boleh terdiri daripada dua jenis: Electrostatic atau Van der Waals. Yang elektrostatik adalah semua di mana kita mempunyai ion, yang dimuatkan secara elektrik atom atau molekul (+ atau -). Sementara itu, orang -orang van der Waals melibatkan atom atau molekul neutral, yang dengan turun naik dalam pengedaran elektronik mereka dipolarisasi dan tertarik atau ditolak antara satu sama lain.
Daya intermolecular dapat dibandingkan dengan kesatuan yang ada di antara kepingan orang awam yang berbeza. Bergantung pada bentuk dan garis panduan mereka, kesatuan mereka menjadi lebih lemah atau lemah, sama seperti mereka mengubah reka bentuk dan dimensi akhir pembinaan.
Semakin kuat daya ini, semakin sukar untuk memisahkan kepingan orang awam atau, dalam hal kimia, molekul. Ini juga bermaksud bahawa akan ada pemadatan yang lebih besar dan oleh itu, molekul akan menentukan lebih banyak cecair likat, gas yang lebih berat atau lebih padat.
Ciri -ciri fizikal lain seperti titik gabungan dan mendidih, turun naik, tekstur, dll., Mereka juga refleks makroskopik daya intermolecular yang mengawal antara molekul atau ion sebatian atau campuran. Sebagai contoh: daya intermolecular gas sangat lemah berbanding dengan batu.
Memahami daya intermolecular adalah penting untuk menggambarkan banyak konsep kimia, fizikal dan biologi.
Kuasa elektrostatik
Ion-ion
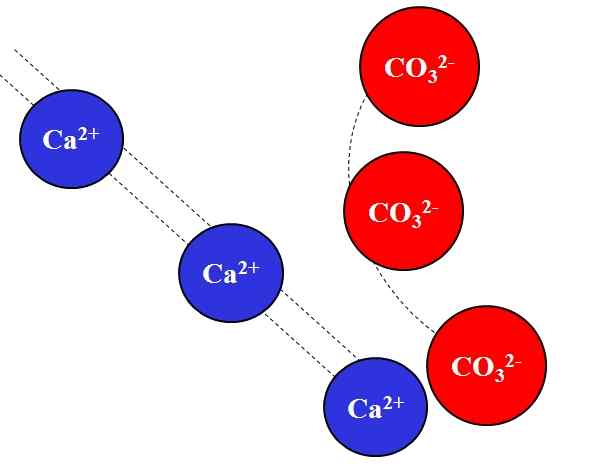 Tarikan elektrostatik antara ion Ca2+ dan CO32-. Sumber: Gabriel Bolívar.
Tarikan elektrostatik antara ion Ca2+ dan CO32-. Sumber: Gabriel Bolívar. Ion caj yang bertentangan menarik dengan kekuatan yang besar, yang disebabkan oleh undang -undang Coulomb, dan dengan cepat mengurangkan lebih banyak ion bergerak jauh.
Contohnya, ca ion2+ Ia adalah caj positif, kation, sementara co32- Ia adalah ion beban negatif, anion. Menjadi beban bertentangan anda, CA2+ dan co32- Mereka saling menarik, membuktikan bahawa semakin dekat mereka, semakin bersama mereka akan kekal.
Sebaliknya, ion dengan beban yang sama, sama ada positif atau negatif, menolak dengan daya yang sama tetapi dalam erti kata yang bertentangan. Oleh itu, CA2+ Menangkis ion seperti na+, Mg2+, K+, dan lain-lain., Kecuali terdapat anion lain yang mengurangkan penolakan.
Ia boleh melayani anda: Dibenzalacetona: sifat, mekanisme tindak balas, kegunaan, risikoDaripada semua daya intermolecular, jenis ion-ion adalah yang paling mudah; Tetapi pada masa yang sama, yang paling kuat dari semua. Banyak tenaga atau haba diperlukan untuk memisahkan ion.
Ion-dipolo
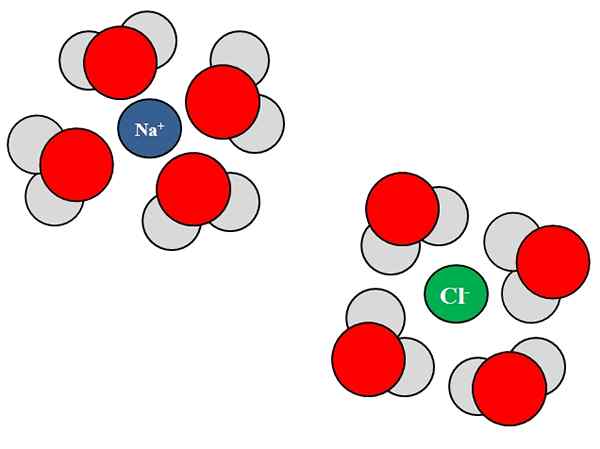 Interaksi ion-dipolo antara molekul air dan ion NaCl. Sumber: Gabriel Bolívar.
Interaksi ion-dipolo antara molekul air dan ion NaCl. Sumber: Gabriel Bolívar. Iones juga boleh berinteraksi dengan atom atau molekul neutral, seperti air. Ini benar terutamanya ketika datang ke molekul pelarut, yang solvata, iaitu, mengelilingi ion dalam cecair mereka.
Sebagai contoh, natrium klorida, NaCl, terdiri daripada ion Na+ dan Cl-. Apabila kristal mereka dibuang ke dalam air, molekul air, h2O atau HOH, menghidrat atau mengelilingi ion NaCl; Tetapi cara mereka lakukan berbeza -beza bergantung kepada ion yang dipersoalkan.
Oleh itu, kita lihat dalam imej yang unggul bahawa ion na+ terhidrasi oleh atom oksigen H2Sama ada. Sementara itu, ion cl- terhidrasi oleh atom hidrogen.
Kerana? Kerana air adalah bahan kutub, yang bermaksud bahawa ia mempunyai dipole: tiang dengan beban separa positif, dan yang lain dengan beban separa negatif.
Atom oksigen, kerana ia lebih elektronegatif, menarik elektron ke arah diri mereka, sehingga mencari elektron lebih kerap di sekitar atom itu; sesuatu yang tidak berlaku sama dengan atom hidrogen, kurang elektronegatif. Oksigen, kerana ia lebih negatif, berorientasikan ke arah NA+; Walaupun hidrogen, kerana mereka lebih positif, berorientasikan ke arah CL-, Sejak caj bertentangan tertarik.
Ion-dipolo yang disebabkan
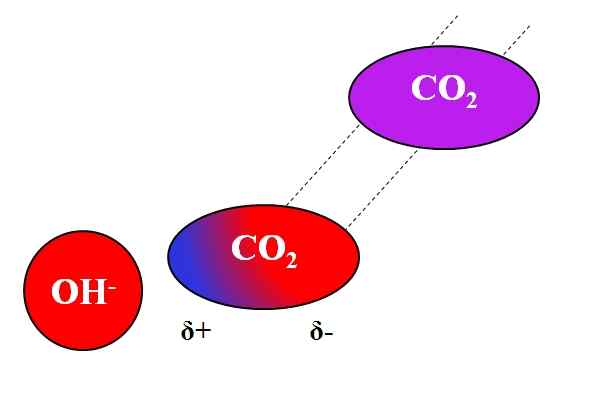 Tindakan Induktif OH- Pada Molekul CO₂. Sumber: Gabriel Bolívar.
Tindakan Induktif OH- Pada Molekul CO₂. Sumber: Gabriel Bolívar. Bukan sahaja molekul kutub atau dipoles dapat berinteraksi dengan ion. Untuk atom atau molekul neutral, walaupun mereka tidak mempunyai dipoles, pengedaran elektron mereka terdedah kepada kesan induktif ion berdekatan; iaitu, ion menyebabkan polarisasi seketika dan ringkas, cukup untuk interaksi yang ketara.
Boleh melayani anda: memimpin asetat: struktur, sifat, mendapatkan, kegunaanKatakan sebagai contoh interaksi antara oh ion- dan co2. Co2 Ia adalah sebatian neutral, yang molekulnya (dalam ungu) tidak mempunyai dipole. Walau bagaimanapun, sebagai OH mendekati-, Beban negatif ini menangkis ke elektron atom oksigen Co2.
Semakin dekat oh- dan co2, lebih kuat akan penolakan. Oleh itu, dipole yang disebabkan oleh OH mula ditubuhkan- Mengenai co2. Tiang positif muncul δ+ kerana elektron, ditolak, "berhijrah" ke hujung molekul yang lain.
Oleh itu, oh- dan co2 Mereka tetap cukup bersama untuk bertindak balas antara satu sama lain. Inilah sebab mengapa co2 Ia sangat larut dalam penyelesaian alkali.
Pasukan van der Waals
Angkatan Van der Waals, pada dasarnya, hanya merujuk kepada mereka yang wujud antara atom neutral atau molekul, tanpa beban ionik.
Dipolo-dipolo (Keesom)
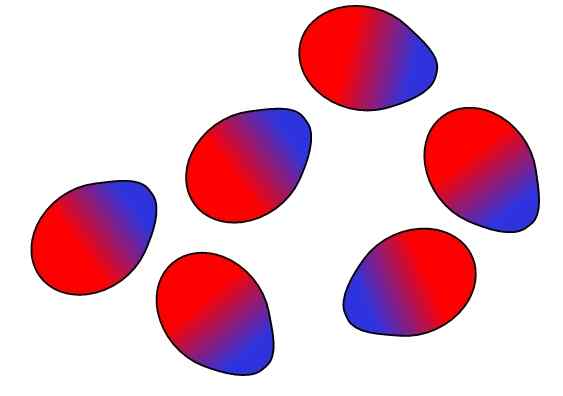 Pasukan Dipolo-dipolo. Sumber: Gabriel Bolívar.
Pasukan Dipolo-dipolo. Sumber: Gabriel Bolívar. Caj bertentangan tertarik, beban yang sama menangkis. Begitu juga dengan dipoles: tiang bertentangan (δ+ dan δ-) tertarik, manakala tiang yang sama menangkis. Kutub positif atau δ+ diwakili di atas dengan warna biru, namun tiang negatif atau δ- diwakili dengan warna merah.
Perhatikan bagaimana molekul teratas berorientasikan dan diperintahkan sedemikian rupa sehingga tiang bertentangan, bergerak jauh dalam proses ke tiang yang sama. Pesanan ini adalah apa yang dikenali sebagai interaksi atau memaksa dipolo-dipolo (daya keesom), dan merupakan daya intermolecular yang paling penting antara molekul kutub.
Contohnya, H molekul2Atau, HCl, HF, Co, antara lain, mereka diperintahkan dalam mod yang serupa. Semakin kutub mereka, semakin kuat pasukan dipole-dipolo akan menjadi; Dan oleh itu, lebih sukar untuk memisahkan molekul mereka.
HF lebih kutub daripada HCl, jadi titik mendidih HF lebih unggul (19.5 ºC) ke HCL (-85.05 ºC). Sangat luar biasa kesan daya intermolecular pada sifat fizikal. Variasi terkecil, dan bahan akan berkelakuan berbeza dari yang diharapkan.
Boleh melayani anda: keadaan gas: ciri -ciri, undang -undang umum, contohDipolo-dipolo yang disebabkan (Debye)
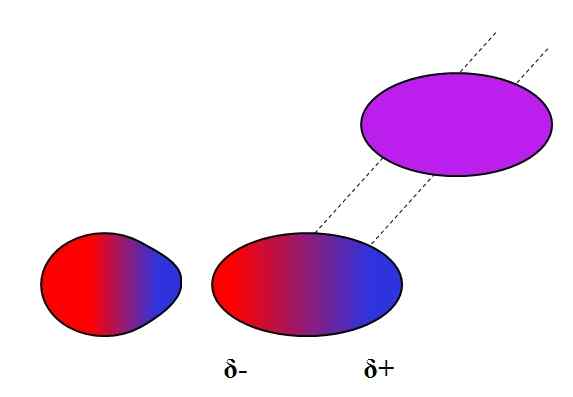 Dipolo-dipolo yang disebabkan. Sumber: Gabriel Bolívar.
Dipolo-dipolo yang disebabkan. Sumber: Gabriel Bolívar. Dipolos, seperti ion, juga boleh turun naik atau menjejaskan pengedaran elektronik atom atau molekul neutral. Oleh itu, kita lihat, dalam imej yang unggul, bahawa dipole tiba -tiba polarisasi molekul neutral. Oleh itu, dikatakan bahawa ia adalah daya dipole-dipole yang disebabkan, kerana dipole kedua adalah seketika, tidak kekal.
Contohnya, air dapat membubarkan sedikit atau2, Tetapi cukup untuk fauna marin untuk bernafas. Jika h2Atau tidak dapat mendorong dipole di o2, Semua oksigen lautan akan melarikan diri dari permukaan, kerana tidak akan ada interaksi antara kedua -dua molekul.
Dipolo yang disebabkan oleh dipolo segera (London)
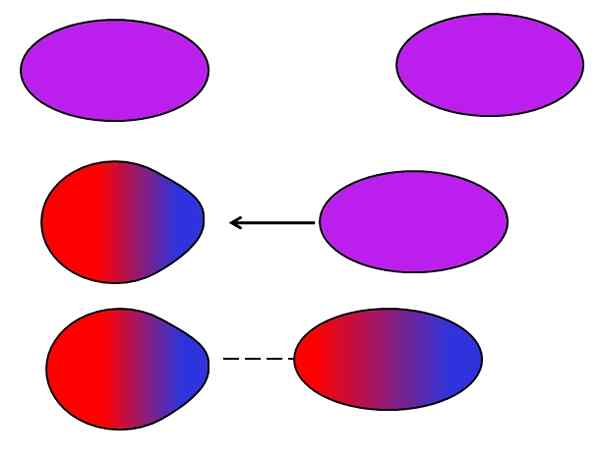 Pasukan London. Sumber: Gabriel Bolívar.
Pasukan London. Sumber: Gabriel Bolívar. Atom atau molekul neutral tidak memerlukan ion jiran atau dipoles untuk menderita untuk turun naik dalam pengagihan beban dalaman mereka. Elektron belum diam, tetapi bergerak sepanjang molekul. Pada satu ketika, dipole segera akan berlaku, yang jika ia sangat dekat dengan molekul atau atom neutral, akan mendorong dipole di dalamnya (lihat di atas).
Molekul ini yang lebih besar dan tidak simetri, semakin besar kemungkinan dipole segera. Itulah sebabnya sebatian jisim atom tertinggi mempunyai daya dipol segera yang disebabkan oleh lebih kuat. Jenis kuasa van der Waals ini lebih dikenali sebagai pasukan London.
Sebagai contoh, gas mulia (dia, ne, ar, dll.) Mereka tetap bersatu terima kasih kepada pasukan London, seperti gas udara (atau2, N2, Co2, dan lain-lain.). Juga, daya ini adalah yang paling utama di kalangan hidrokarbon seperti metana, cho4, Dan propana, cho3Ch2Ch3.
Kuasa hidrofobik
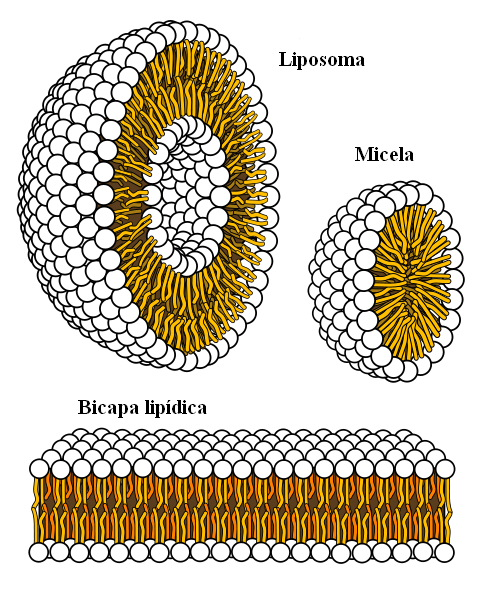 Struktur supramolekul berasal dari daya hidrofobik
Struktur supramolekul berasal dari daya hidrofobik Akhir. Lemak tidak berkaitan dengan air, jadi tidak larut dalam hal ini.
Molekul lemak berusaha untuk berkumpulan sedemikian rupa sehingga interaksi mereka dengan air adalah sebanyak mungkin, dan ini dapat membentuk struktur 3D seperti yang ditunjukkan di atas.
Oleh itu, molekul lemak, seperti fosfolipid, berkumpul untuk membentuk lipid bilayers, micelles dan liposomes.
Jika diperhatikan, molekul ini mempunyai kepala putih yang mewakili bahagian kutub, yang berkaitan dengan air; serta ekor apolar, yang menangkis molekul air. Garis ini berusaha meletakkan diri mereka di dalam struktur supramolekul ini, sehingga mereka tidak berinteraksi dengan air.

