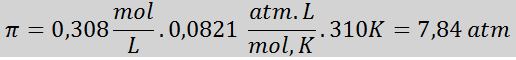Ciri -ciri penyelesaian penyelesaian
- 2184
- 377
- Kerry Schmitt
Apakah sifat koligatif?
The Ciri -ciri Colligative, Juga dipanggil sifat kolektif penyelesaian, mereka adalah sekumpulan empat sifat yang bergantung semata -mata kepada jumlah zarah yang ada dalam larutan, tetapi tidak pada sifat zarah -zarah ini.
Dalam erti kata lain, sifat -sifat ini timbul dari kehadiran zarah selain pelarut, iaitu zarah larut, tetapi tidak bergantung pada siapa larut itu. Sebarang jenis zarah boleh menimbulkan sifat koligatif, tidak kira sama ada atom, ion atau molekul. Satu -satunya perkara yang penting ialah kepekatan anda.
Ciri -ciri koligatif adalah empat:
- Keputusan tekanan stim pelarut
- Ketinggian ebullloscopic
- Keturunan crioscopic
- Tekanan osmotik
Semua dicirikan dengan berkadar dengan kepekatan larut dalam hal penyelesaian yang agak cair (kepekatan <0,2 M). Para soluciones más concentradas, el comportamiento se torna más complejo y difícil de analizar.
Mari lihat setiap empat sifat ini secara terperinci:
1. Keputusan tekanan stim pelarut
Apabila larutan larut tidak bersuara disediakan, tekanan stim penyelesaian yang terhasil selalu kurang daripada tekanan wap pelarut tulen. Dalam erti kata lain, larut larutan yang tidak menonjol dalam pelarut, menyebabkan penurunan tekanan wap pelarut tersebut, berbanding pelarut tulen.
Formula tekanan stim berkurangan
Seperti semua sifat koligatif, penurunan tekanan stim (dp) adalah berkadar dengan kepekatan larut. Menggabungkan undang -undang Raault dengan persamaan pecahan molar, dapat ditunjukkan bahawa DP diberikan oleh:
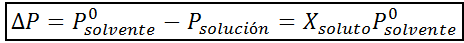
di mana p °pelarut mewakili tekanan wap pelarut tulen pada suhu tertentu, ppenyelesaian sepadan dengan tekanan wap penyelesaian dan xlarut mewakili kepekatan larut yang dinyatakan sebagai pecahan molar.
Mengapa mengurangkan tekanan stim dengan larutan?
Kekuatan yang mendorong proses yang paling semula jadi, seperti penyejatan pelarut, adalah peningkatan entropi atau tahap gangguan. Apabila cecair menguap, ia pergi dari keadaan yang sangat teratur (dalam cecair) ke sangat kemas (dalam gas), kerana dalam fasa gas terdapat lebih banyak kebebasan bergerak.
Boleh melayani anda: kaca violetWalau bagaimanapun, dalam penyelesaian, kehadiran larutan menambah gangguan kepada fasa cecair sementara tidak menjejaskan fasa gas (kerana larut tidak menguap).
Atas sebab ini, perbezaan tahap gangguan antara penyelesaian dan fasa gas kurang daripada antara pelarut tulen dan fasa gas, jadi pelarut mempunyai kecenderungan yang kurang untuk menguap dalam kes kedua.
Contoh
Masalah: Mengetahui bahawa tekanan wap air pada suhu tertentu ialah 30.55 mmHg, tentukan tekanan wap larutan yang disediakan untuk melarutkan 7.20 gram glukosa (jisim molar atau mm = 180g/mol) dalam 360 g air (mm = 18.0 g/mol) pada suhu yang sama.
Penyelesaian: Dalam kes ini, pecahan molar larut mesti dikira terlebih dahulu. Kami sudah mempunyai semua data yang diperlukan untuk ini:
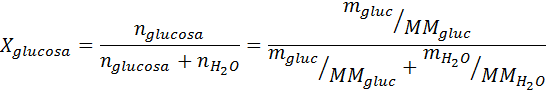
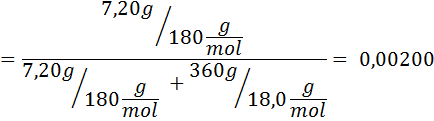
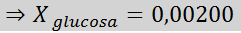
Kemudian persamaan penurunan tekanan stim digunakan.
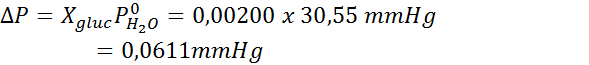
Sekarang kita menentukan tekanan stim baru pelarut:
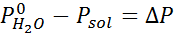
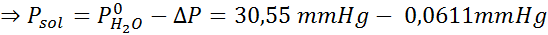
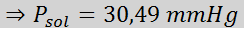
2. Ketinggian ebullloscopic atau titik mendidih
Ketinggian ebullloscopic merujuk kepada peningkatan titik mendidih penyelesaian berbanding dengan titik mendidih pelarut tulen. Untuk memahami mengapa ini berlaku, ingat bahawa titik mendidih ditakrifkan sebagai suhu di mana tekanan wap cecair dilakukan sama dengan tekanan atmosfera.
Oleh kerana penyelesaiannya mempunyai tekanan stim yang lebih kecil daripada pelarut tulen (seperti yang telah kita lihat di bahagian sebelumnya), perlu memanaskannya lebih banyak untuk dapat mencapai tekanan atmosfera dan dengan itu mencapai titik mendidihnya. Atas sebab ini, titik mendidih penyelesaian (dengan larutan yang tidak menonjol) selalu lebih besar daripada pelarut murni.
Formula ketinggian ebullloscopic
Peningkatan titik mendidih (DTb) Ia berkadar dengan kepekatan larut yang dinyatakan dalam molealitas, seperti yang ditunjukkan oleh persamaan berikut:
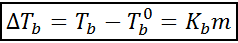
Di mana tb Ia adalah titik mendidih penyelesaian, tb° Ia adalah titik mendidih pelarut tulen, kb Ia adalah pemalar ebullloscopic pelarut dan m Itu adalah moleality larut.
Contoh
Masalah: Mengetahui bahawa pemalar air mendidih adalah 0.52 ° C.kg/mol, tentukan titik mendidih penyelesaian glukosa yang disediakan dalam contoh sebelumnya.
Penyelesaian: Untuk menentukan ketinggian ebullloscopic kita hanya memerlukan moralitas.
Boleh melayani anda: Tin Oxide (II): Struktur, sifat, Tata nama, Kegunaan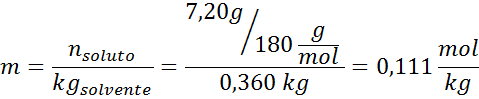
Sekarang kita menggunakan formula DTb:
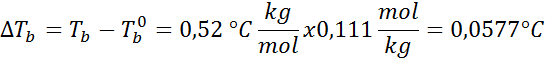
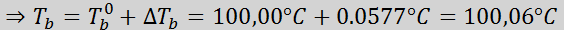
3. Keturunan crioscopic
Pengurangan cryoscopic adalah penurunan titik pembekuan penyelesaian berbanding dengan titik pembekuan pelarut tulen. Sebab ini berlaku adalah serupa dengan kenaikan ebullloscopic dan berasal dari penurunan tekanan stim.
Harta ini digunakan secara meluas dalam cuaca sejuk di mana ia bersalju pada musim sejuk. Di negara -negara ini, sangat biasa melihat trak menyebarkan garam seperti NaCl atau CaCl2 di jalan raya atau di bangku awam, selepas itu salji cair. Sebabnya mencairkan bahawa garam mengurangkan titik pembekuan air.
Formula keturunan crioscopic
Persamaan keturunan crioscopic sangat serupa dengan peningkatan ebullloscopic. Ia juga berkadar dengan kepekatan moral dan bergantung, dalam kes ini, pada pemalar cryoscopic pelarut.
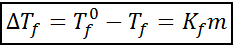
di mana tF Ia adalah titik pembekuan penyelesaian, tF° Ia adalah titik pembekuan pelarut tulen, kF Ia adalah pemalar crioscopic pelarut dan m Itu adalah moleality larut.
Contoh
Masalah: Mengetahui bahawa pemalar air cryoscopic adalah 1.86 ° C.kg/mol, tentukan titik pembekuan penyelesaian glukosa yang disediakan dalam contoh sebelumnya.
Penyelesaian: Moral penyelesaian sudah ditentukan, jadi kita dapat menentukan dt secara langsungF Menggunakan formula sebelumnya:
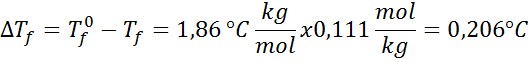
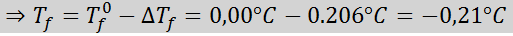
4. Tekanan osmotik
Osmosis adalah proses yang sangat penting di peringkat kimia dan biologi. Ini terdiri daripada aliran molekul pelarut (contohnya, air) dari penyelesaian yang dicairkan kepada penyelesaian lain yang lebih tertumpu apabila ia dipisahkan dengan cara membran semipermeable (yang hanya membolehkan pelarut hanya lulus, tetapi bukan larut).
Kecenderungan ini untuk "menyerap" pelarut melalui membran semipermeable adalah harta yang hanya bergantung pada kepekatan jumlah zarah larut yang ada dalam larutan, tanpa mengira apa itu larut. Atas sebab ini, trend ini adalah harta koligatif, dan diukur melalui tekanan osmotik.
Tekanan osmotik (π) adalah tekanan yang harus digunakan untuk penyelesaian untuk menghentikan osmosis. Semakin besar tekanan osmotik, lebih banyak kecenderungan penyelesaian untuk menyerap pelarut (atau, lebih tepatnya, lebih banyak trend pelarut untuk menyebar ke arah penyelesaian itu) mempunyai penyelesaiannya).
Boleh melayani anda: magnesium: sejarah, struktur, sifat, reaksi, kegunaanMengapa osmosis berlaku?
Penjelasan di sebalik proses osmosis sangat mudah. Semua bahan cenderung menyebar dari mana mereka lebih tertumpu di mana mereka lebih cair. Ini diberitahu untuk mengikuti kecerunan tumpuan anda.
Apabila penyelesaian lebih tertumpu dalam larutan, pada masa yang sama ia lebih dicairkan dalam pelarut dan sebaliknya. Atas sebab ini, pelarut mempunyai kecenderungan semula jadi untuk pergi dari penyelesaian yang paling dicairkan (di mana pelarut lebih tertumpu) ke arah penyelesaian yang paling pekat (di mana ia lebih dicairkan).
Formula tekanan osmotik
Tekanan osmotik boleh dikira dengan formula yang sangat mirip dengan persamaan gas ideal:
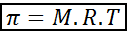
Dalam persamaan ini, π adalah tekanan osmotik, M ialah kepekatan molar larut, R adalah pemalar sejagat gas ideal (0.0821 atm.L/mol.K) dan t adalah suhu mutlak dalam k.
Tekanan dan tonik osmotik
Tekanan osmotik sangat penting untuk berfungsi badan manusia. Sebenarnya, penyelesaian salin yang disuntik secara intravena diklasifikasikan mengikut sama ada tekanan osmotik mereka lebih besar, sama dengan atau kurang daripada plasma darah kepada apa yang dipanggil tonicity.
- Penyelesaian yang kurang pekat bahawa plasma mempunyai tekanan osmotik yang lebih rendah dan diberitahu Penyelesaian hipotonik.
- Sekiranya anda mempunyai jumlah kepekatan larutan yang sama, ia diberitahu penyelesaian isotonik.
- Sekiranya anda mempunyai tekanan osmotik (atau tumpuan) yang lebih besar, diberitahu penyelesaian hipertonik.
Contoh
Masalah: Kirakan tekanan osmotik pada 310 k larutan salin 0.9% (m/v), yang isotonik dengan plasma darah.
Penyelesaian: Kami sudah mempunyai suhu, jadi satu -satunya perkara yang hilang adalah untuk menentukan kepekatan molar zarah garam (NaCl) dalam larutan. Untuk ini.
Setiap 100 ml larutan mengandungi 0.9 g NaCl, jadi:
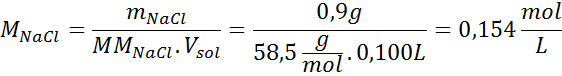
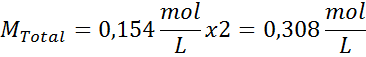
Ini adalah jumlah kepekatan zarah larut dalam larutan, jadi sekarang kita dapat mengira tekanan osmotik: