Sifat alkil halogenuros, mendapatkan, contoh
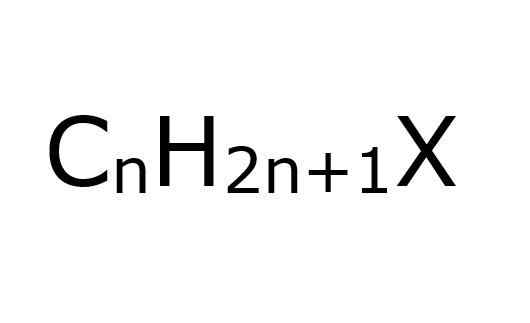
- 1262
- 293
- Donnie Ryan
The alkil halogenuros Mereka adalah sebatian organik di mana atom karbon dengan hibridisasi SP3 Halogen dikaitkan dengan kovalen (f, cl, br, i). Dari perspektif yang lain, mudah, untuk memudahkan, mengandaikan bahawa mereka adalah haloalcanos; Ini adalah, kepada mereka yang telah menggantikan beberapa atom halogen.
Juga, seperti namanya, atom halogen mesti dikaitkan dengan kumpulan alquilical, r, yang dipertimbangkan jenis halogenida ini; Walaupun, secara struktural mereka boleh diganti atau bercabang dan mempunyai cincin aromatik, dan masih terus menjadi alkil halogenida.
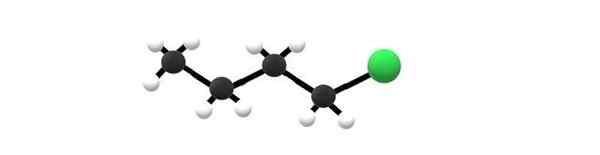 Molekul 1-Chlorobutano, contoh alkil halogenida. Sumber: Gabriel Bolívar.
Molekul 1-Chlorobutano, contoh alkil halogenida. Sumber: Gabriel Bolívar. Di atas anda mempunyai molekul 1-chlorobutano, yang sepadan dengan salah satu halogenida alkil yang paling mudah. Dapat dilihat bahawa semua karbon mereka mempunyai ikatan mudah, dan juga mempunyai hibridisasi SP3. Oleh itu, sfera hijau, sepadan dengan atom Cl, dikaitkan dengan kerangka yang diperolehi dari alkane butana.
Contohnya lebih mudah daripada 1-chlorobutano adalah yang berasal dari gas metana: hidrokarbon terkecil dari semua.
Dari molekul cho4 Anda boleh menggantikan atom H oleh, untuk mengatakan, iodin. Sekiranya H diganti, CH akan3I (yodomethane atau metil iodida). Apabila dua h diganti, ch akan2Yo2 (Diyodomethane atau metilena iodida). Diikuti dan akhirnya, saya menggantikan semua h memberikan chi3 (iodoform), dan CI4 (Karbon tetrayoduro).
Sewa Halogenuros dicirikan dengan sangat reaktif dan, mempunyai atom elektronegatif yang paling banyak dalam jadual berkala, ia adalah intuited bahawa melalui mekanisme simfines mempengaruhi pengaruh pada matriks biologi.
[TOC]
Sifat halogenuros alkil
Sifat -sifat keluarga sebatian ini bergantung pada struktur molekulnya. Walau bagaimanapun, jika dibandingkan dengan alkana mereka, perbezaan yang ketara yang disebabkan oleh fakta mudah terdapat pautan C-X (x = atom halogen).
Iaitu, pautan C-X bertanggungjawab untuk sebarang perbezaan atau persamaan antara satu atau lebih alkil halogenuros.
Untuk memulakan, pautan C-H hampir apolar, memandangkan perbezaan elektronegativiti yang rendah antara C dan H; Sebaliknya, pautan C-X mempunyai momen dipole tetap, kerana halogen lebih elektronegatif daripada karbon (terutama fluorin).
Sebaliknya, beberapa halogen adalah cahaya (f dan cl), sementara yang lain berat (br dan i). Jisim atomnya juga membentuk perbezaan dalam pautan C-X; Dan seterusnya, secara langsung dalam sifat halogenida.
Oleh itu, menambah halogen ke hidrokarbon adalah sama dengan meningkatkan polaritas dan jisim molekul; Ia adalah sama untuk menjadikannya kurang menantang (sedikit sebanyak), kurang mudah terbakar, dan meningkatkan mata mendidih atau gabungannya.
Mata mendidih dan gabungan
Di atas ditunjukkan, dalam urutan yang semakin meningkat, saiz dan oleh itu berat halogen yang berbeza:
F < Cl < Br < I
Kemudian, diharapkan alkil halogenida yang mengandungi atom F lebih ringan daripada mereka yang mempunyai atom BR atau I.
Sebagai contoh, beberapa halogenuros yang diperoleh daripada metana dianggap:
Ch3F < CH3Cl < CH3Br < CH3Yo
Ch2F2 < CH2Cl2 < CH2Br2 < CH2Yo2
Dan sebagainya untuk produk derivatif lain dari tahap halogenasi yang lebih tinggi. Perhatikan bahawa pesanan dikekalkan: halogenuros fluorin lebih ringan daripada yodium. Bukan itu sahaja, tetapi juga mata mendidih dan gabungannya juga mematuhi perintah ini; RF mendidih pada suhu yang lebih rendah daripada RI (R = CHO3, untuk kes ini).
Boleh melayani anda: penggantian elektrofilik aromatik: mekanisme dan contohBegitu juga, semua cecair itu tidak berwarna, kerana dalam ikatan C-X mereka, elektron tidak dapat menyerap atau melepaskan foton untuk mengembara tahap tenaga lain. Walau bagaimanapun, ketika mereka menjadi lebih berat, mereka dapat mengkristal dan mempamerkan warna (seperti yang dilakukan oleh Iodoform, Chi3).
Polariti
Pautan C-X berbeza daripada polariti, tetapi dalam urutan terbalik di atas:
C-f> c-cl> c-br> c-i
Oleh itu, pautan c-f lebih kutub daripada pautan c-i. Menjadi lebih kutub, halogenuros RF cenderung berinteraksi melalui pasukan dipole-dipolo. Sementara itu, dalam halogenuros RBR atau RI, momen dipole mereka lebih lemah dan interaksi yang ditadbir oleh pasukan penyebaran London mendapat kekuatan yang lebih besar.
Kuasa pelarut
Oleh kerana halogenida alkil lebih kutub daripada alkana dari mana mereka memperoleh, mereka meningkatkan keupayaan mereka untuk membubarkan sebilangan besar sebatian organik. Oleh sebab itu, mereka cenderung menjadi pelarut yang lebih baik; Walaupun, ini tidak bermakna bahawa mereka boleh menggantikan alkana dalam semua aplikasi.
Terdapat kriteria teknikal, ekonomi, ekologi dan prestasi untuk memilih pelarut halogenasi ke atas alkane.
Nomenclature
Terdapat dua cara untuk menamakan alkil halogenida: dengan nama biasa, atau dengan nama sistematiknya (IUPAC). Nama biasa biasanya lebih selesa untuk digunakan apabila Rx adalah mudah:
Chcl3
Kloroform: nama biasa
Metil atau trichloromethane trichloride: nama iupac.
Tetapi nama sistematik lebih baik (dan satu -satunya pilihan), apabila mereka mempunyai struktur bercabang. Ironinya, nama biasa berguna sekali lagi apabila struktur terlalu rumit (seperti yang akan dilihat di bahagian terakhir).
Peraturan untuk menamakan sebatian mengikut sistem IUPAC adalah sama seperti untuk alkohol: rantaian utama dikenalpasti, yang paling lama atau yang paling bercabang. Kemudian, karbon disenaraikan bermula pada akhir yang paling dekat dengan substituen atau ramuan, menamakan urutan abjad.
Contoh
Untuk menggambarkannya, anda mempunyai contoh berikut:
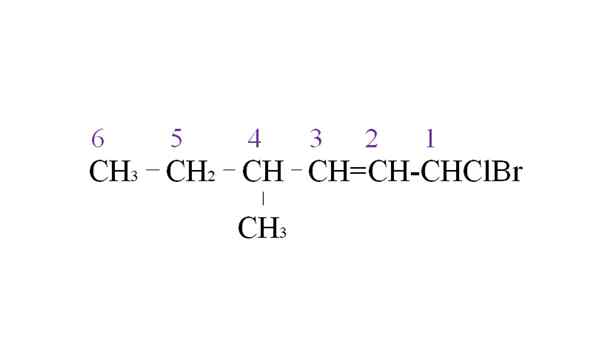 Sewa halogenida sebagai contoh tatanama. Sumber: Gabriel Bolívar.
Sewa halogenida sebagai contoh tatanama. Sumber: Gabriel Bolívar. Cawangan pertama adalah kumpulan metil dalam C-4; Tetapi, mempunyai ikatan berganda ini keutamaan awal mengenai peraturan yang dinyatakan. Atas sebab itu, rantai terpanjang mula disenaraikan dari kanan, yang diketuai oleh atom karbon yang dikaitkan dengan dua halogen: Cl dan Br.
Dengan penghitungan, substituen dinamakan dalam susunan abjad:
1-bromo-1-clor-4-methyl-2-hexen.
Memperoleh
Untuk mendapatkan halogenida alkil, molekul mesti dikemukakan kepada proses halogenasi; iaitu, untuk menggabungkan atom halogen ke dalam struktur mereka, terutamanya kepada atom ke SP A karbon3.
Terdapat dua kaedah untuk mendapatkan atau mensintesisnya: oleh sinaran ultraviolet melalui mekanisme radikal bebas, atau dengan menambahkan hidrakest atau halogen.
Halogenasi dengan sinaran cahaya atau ultraviolet
Yang pertama, paling tidak sesuai dan dengan hasil yang paling teruk, terdiri daripada penyinaran alkana dengan radiasi ultraviolet (Hv) Di hadapan halogen. Sebagai contoh, persamaan untuk pengklorinan metana ditunjukkan:
Ch4 + Cl2 => Ch3CL + HCL (di bawah cahaya ultraviolet)
Ch3Cl + Cl2 => Ch2Cl2 + HCl
Ch2Cl2 + Cl2 => CHCl3 + HCl
Chcl3 + Cl2 => CCl4 + HCl
Empat sebatian (CH3CL, ch2Cl2, Chcl3 dan CCL4) Mereka terbentuk, dan oleh itu terdapat campuran, yang boleh dikenakan penyulingan pecahan. Walau bagaimanapun, kaedah ini tidak begitu praktikal, dan lebih suka menggunakan sintesis organik.
Boleh melayani anda: asid fenilasi: struktur, sifat, kegunaan, kesanSatu lagi contoh ialah bromasi n-heksana:
Ch3Ch2Ch2Ch2Ch2Ch3 + Br2 => Ch3(Br) CHCH2Ch2Ch2Ch3 + Hbr
Sekali lagi, dalam tindak balas ini radiasi cahaya atau ultraviolet digunakan untuk memihak kepada pembentukan radikal bebas. Bromin, seperti cecair merah yang sengit, berubah warna kerana ia bertindak balas, dengan itu mengamati perubahan warna merah ke warna-warna apabila 2-bromoheksan.
Penambahan hidrakest atau halogen ke alkena
Kaedah kedua untuk mendapatkan alkil halogenuros adalah untuk merawat alkohol (ROH) atau alkenes (r2C = Cr2) Dengan hidrace. Hydracides mempunyai formula umum HX (HF, HCL, HBR dan HI). Contohnya akan ditunjukkan menggunakan etanol untuk setiap mereka:
Ch3Ch2Oh + hf => ch3Ch2F + h2Sama ada
Ch3Ch2Oh + hcl => ch3Ch2CL + H2Sama ada
Ch3Ch2Oh + hbr => ch3Ch2Br + h2Sama ada
Ch3Ch2Oh + hi => cho3Ch2I + h2Sama ada
Juga, alkena boleh menambah molekul HX ke ikatan berganda mereka, membentuk halogenuros alkil sekunder.
Ch2= Ch-ch3 + Hbr => brch2-Ch2-Ch3 + Ch3-CHBR-CH3
Produk BRCH2-Ch2-Ch3 Ia adalah 1-bromopropano, dan cho3-CHBR-CH3 The 2-Bromopropan. Yang kedua adalah produk majoriti kerana ia adalah yang mempunyai kestabilan terbesar, sementara yang pertama dihasilkan ke tahap yang lebih rendah kerana ia lebih tidak stabil. Ini kerana cho3Chbrch3 Ia adalah alkil halogenida sekunder.
Sangat serupa berlaku apabila apa yang ditambahkan ke alkena adalah molekul x2:
Ch2= Ch-ch3 + Br2 => Brch2-CHBR-CH3
Walau bagaimanapun, alkil halogenida dengan dua atom bromin yang dikaitkan dengan karbon bersebelahan diperolehi; Kejiranan Alkyl Halogenide. Jika, sebaliknya, kedua -dua bomos yang dikaitkan dengan karbon yang sama diambil, akan ada halogenida alkil geminal, seperti yang berikut:
Br2CH-CH2-Ch3
Reaksi
Penggantian nukleofilik
Reaktiviti halogenida alkil dalam kerapuhan atau rintangan pautan c-x. Semakin berat halogen, semakin lemah ikatan akan, dan oleh itu, ia akan pecah lebih mudah. Dalam pautan tindak balas kimia dipecahkan dan yang baru terbentuk; Pautan C-X dipecahkan, untuk membentuk pautan C-G (G = kumpulan baru).
Dalam istilah yang lebih sesuai, x bertindak sebagai kumpulan keluar, dan g sebagai kumpulan yang masuk dalam reaksi Penggantian nukleofilik. Mengapa tindak balas ini berlaku? Kerana x, lebih banyak elektronegatif daripada karbon, "mencuri" ketumpatan elektronik meninggalkan defisit elektron yang diterjemahkan sebagai beban separa positif:
Cδ+-Xδ-
Sekiranya spesies negatif berada di sekitar sekitar (: g-) atau neutral dengan sepasang elektron yang tersedia (: g), mampu membentuk pautan c-g yang lebih stabil, x akan digantikan oleh g. Di atas boleh diwakili dengan persamaan kimia berikut:
Rx +: g- => Rg + x-
Semakin lemah pautan c-x atau r-x, semakin besar kereaktifan atau kecenderungannya digantikan oleh Ejen nukleofilik (atau nukleofil) g; iaitu pencinta nukleus atau caj positif.
Contoh
Satu siri persamaan umum untuk penggantian nukleofilik yang mungkin mengalami halogenida alkil ditunjukkan di bawah:
Rx + oh- => Roh + x- (Alkohol)
+ Atau'- => Ror' (Ethers, Sintesis Williamson)
+ Yo- => Ri (alkil yoduros)
+ CN- => RCN (Nitrilos)
+ R'COO- => Rcoor '(ester)
+ NH3 => Rnh2 (Amina)
+ P (c6H5)3 => Rp (c6H5)3+ X- (Garam fosfonium)
+ Sh- => Rsh (tioles)
Boleh melayani anda: Tahap KimiaDari contoh -contoh ini, halogenida alkil berharga untuk sintesis organik boleh disyaki. Salah satu daripada banyak penggantian yang hilang ialah reaksi Friedel Crafts, yang digunakan untuk "menyewa" cincin aromatik:
Rx + arh + alcl3 => Rra
Dalam tindak balas ini, H dari cincin aromatik digantikan oleh kumpulan r -dari Rx.
Penghapusan
Sewa halogenida boleh melepaskan molekul HX melalui tindak balas penghapusan; Khususnya, dehydrohalogenation:
R2CH-CXR2 + Oh- => R2C = Cr2 + Hx
Dikatakan bahawa dehydrohalogenation berlaku kerana kedua -dua H dan x hilang dalam molekul Hx yang sama.
Sintesis reagen Grignard
Sewa halogenida boleh bertindak balas dengan logam tertentu yang membentuk reagen Grignard, digunakan untuk menambah kumpulan R ke molekul lain. Persamaan umum sintesisnya adalah seperti berikut:
Rx + mg => rmgx
Contoh
Sepanjang bahagian, beberapa contoh alkil halogenuros telah disebutkan. Beberapa yang lain, mudah, adalah:
-Ethyl Chloride, CH3Ch2Cl
-Isopropil fluoruro, (ch3)2Ch2F
-2-methyl-3-chloropentano, ch3-CH (Ch3) -Chcl -ch2Ch3
-Secbutilo Yoduro, CH3Ch2Ch2I-ch3
-3-bromo-6-iodheptano, ch3-Ch2-CHBR-CH2-Ch2-Ch2Yo
-3.4-Dibromo-1-Penteno, ch3-CHBR-CHBR-CH = CH2
Aplikasi
Pelarut
Di bahagian sebelumnya, sebutkan kapasiti pelarut halogenida alkil dibuat. Dari harta ini, industri telah mengambil kesempatan daripada mereka sebagai pembersih, sama ada untuk bahan tekstil, komponen elektronik, atau mengeluarkan bintik -bintik varnis.
Mereka juga digunakan sebagai pelarut lukisan, atau sampel organik atau lemak untuk jenis ujian analisis yang tak terhitung jumlahnya.
Sintesis organik
Sewa halogenuros sangat berguna untuk "menyewa" cincin aromatik, sambil berfungsi sebagai sumber permulaan untuk sintesis praktikal semua keluarga lain dari sebatian organik. Secara sintetik, Rx dianggap sebagai sumber kumpulan atau rantai R, yang boleh diinginkan untuk menggabungkan sebatian yang sangat aromatik.
Industri farmaseutikal
Ia disebut pada mulanya bahawa atom halogen berinteraksi dengan matriks biologi, jadi dalam organisma kita tidak dapat disedari tanpa menghasilkan perubahan, positif atau negatif. Sekiranya ubat memberi kesan positif kepada badan, mempunyai atom halogen yang kesannya mungkin atau mungkin tidak meningkat.
Oleh itu, jika x secara langsung dikaitkan dengan karbon dengan hibridisasi SP3, akan ada alkil halogenida dan bukan derivatif halogenasi. Beberapa halogenuro tersebut ditunjukkan di bawah dalam siri imej berikut:
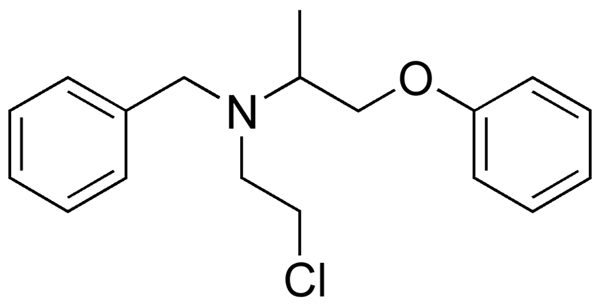 Phenoxibenzamine, ubat yang digunakan untuk menggabungkan tekanan darah pada pesakit dengan pheochromocytoma. Sumber: Utennt: Mark Pea [Domain Awam].
Phenoxibenzamine, ubat yang digunakan untuk menggabungkan tekanan darah pada pesakit dengan pheochromocytoma. Sumber: Utennt: Mark Pea [Domain Awam].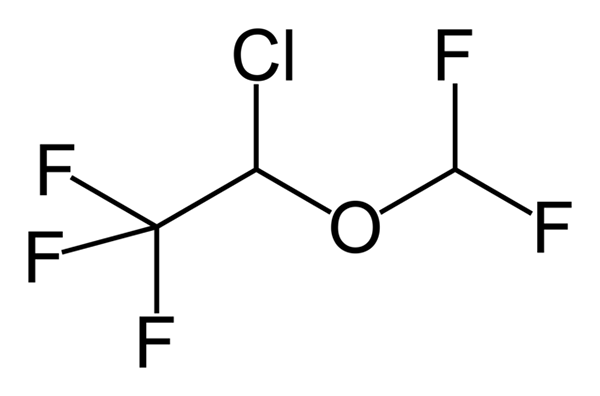 Isoflurano, anestetik penyedutan. Sumber: Benjah-bmm27 [domain awam].
Isoflurano, anestetik penyedutan. Sumber: Benjah-bmm27 [domain awam].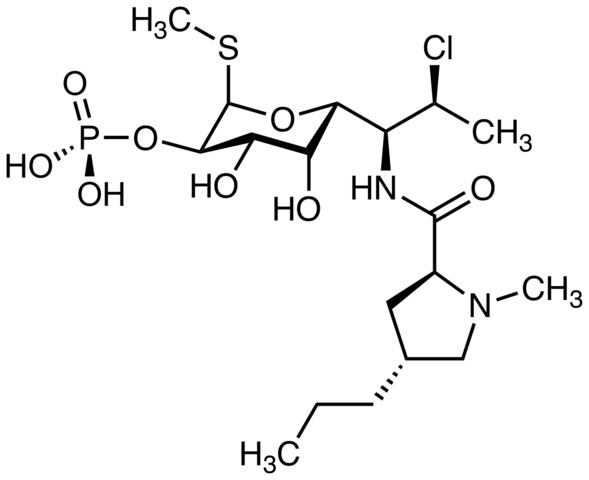 Clindamycin, antibiotik. Sumber: M Mitcheltrate [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)].
Clindamycin, antibiotik. Sumber: M Mitcheltrate [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)].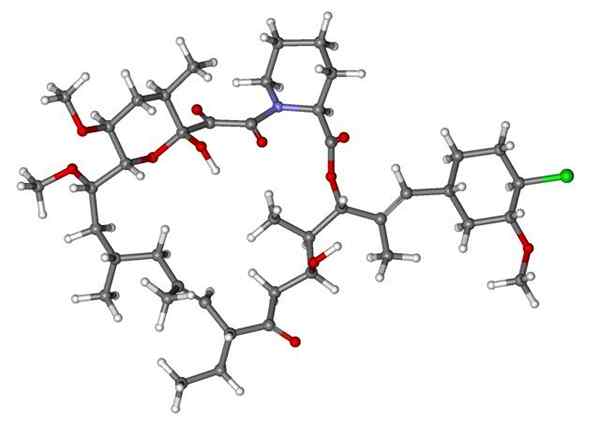 Pimecrolimus, digunakan untuk merawat dermatitis atopik. Bolehkah anda mencari atom klorin? Sumber: Marinavladivok [CC0].
Pimecrolimus, digunakan untuk merawat dermatitis atopik. Bolehkah anda mencari atom klorin? Sumber: Marinavladivok [CC0]. Halomon, kemungkinan agen antitumoral dan alkil halogenida alga rumpai laut portieria hornemannii, sumber semula jadi. Sumber: Jü [Domain Awam]
Halomon, kemungkinan agen antitumoral dan alkil halogenida alga rumpai laut portieria hornemannii, sumber semula jadi. Sumber: Jü [Domain Awam]
Perhatikan bahawa dalam lima ubat ini terdapat sekurang -kurangnya satu pautan jenis CHO2-X atau ch-x; Iaitu, halogen dikaitkan dengan sp -carbon3.
Penyejuk
Penyejuk Freón-12 yang terkenal (CHCIF2), Seperti fluoroalcanos atau hidrofluorokarbon lain, mereka menggantikan ammonia dan chlorofluorocarbons (CFCs) dalam fungsi ini kerana, walaupun bahan tidak berubah -ubah atau toksik, mereka memusnahkan lapisan ozon; Walaupun Freón-12, kerana ia lebih reaktif, dimusnahkan sebelum mencapai ketinggian tersebut.
Rujukan
- Carey f. (2008). Kimia organik. (Edisi keenam). MC Graw Hill.
- Clark Jim. (14 Julai 2016). Penggunaan halid alkil. Kimia Librettexts. Pulih dari: chem.Libretxts.org
- Gál, b., Bucher, c., & Burns, n. Z. (2016). Chiral Alkyl Halides: Motif yang kurang jelas dalam Perubatan. Dadah Marin, 14 (11), 206. Doi: 10.3390/MD14110206
- Alkil halida. Diperolehi daripada: Chemed.Chem.Purdue.Edu
- Patkar Prachi. (16 Julai 2017). Semua mengenai alkil halida: sifat, kegunaan, dan banyak lagi. Sains Struct. Pulih dari: Sciencestruck.com
- R. kapal. (2016). Alkil halida. Pulih dari: Hyperphysics.Phy-Astr.GSU.Edu
- Panduan Pembelajaran untuk Bab 9 - Alkyl Halides I. Pulih dari: kaktus.Dixie.Edu
- Q.Ke. Eduardo Vega Barrios. (s.F.). Sewa Halogenuros: Hartanah, Kegunaan dan Aplikasi. [Pdf. Pulih dari: cvonline.Uaeh.Edu.mx
- « Struktur Asid Nitrous (HNO2), sifat, sintesis
- Struktur, sifat, penggunaan, penggunaan litium bromida lithium bromide »

