Struktur Asid Nitrous (HNO2), sifat, sintesis

- 3901
- 561
- Mr. Tracy Parisian
Dia Asid nitrous Ia adalah asid yang lemah dan tidak organik, yang formula kimianya adalah hno2. Ia pada asasnya dalam larutan akueus dengan warna biru pucat. Ia sangat tidak stabil, dan ia dengan cepat dipecah menjadi nitrik oksida, tidak, dan dalam asid nitrik, ino3.
Biasanya dalam larutan akueus dalam bentuk nitrit. Ia juga secara semula jadi berasal dari atmosfera akibat tindak balas nitrik oksida dengan air. Di sana, khususnya di troposfera, asid nitrous campur tangan dalam peraturan kepekatan ozon.
 Larutan asid nitrous dalam bikar. Sumber: Tiada pengarang yang boleh dibaca mesin yang disediakan. Saintis Mad ~ Commonswiki diasumsikan (berdasarkan tuntutan hak cipta). [Domain awam]
Larutan asid nitrous dalam bikar. Sumber: Tiada pengarang yang boleh dibaca mesin yang disediakan. Saintis Mad ~ Commonswiki diasumsikan (berdasarkan tuntutan hak cipta). [Domain awam] Pada gambar atas penyelesaian HNO ditunjukkan2 di mana warna biru pucat ciri asid ini dapat dilihat. Ia disintesis oleh pembubaran nitrogen trioksida, n2Sama ada3, Dalam air. Begitu juga, produk pengasidan penyelesaian nitrit natrium pada suhu rendah.
Hno2 Ia mempunyai sedikit penggunaan komersial, menggunakan dalam bentuk nitrit dalam pemuliharaan daging. Sebaliknya, ia digunakan dalam penjelasan pewarna azoik.
Ia digunakan, bersama -sama dengan natrium thiosulfate, dalam rawatan pesakit dengan keracunan natrium sianida. Tetapi, ia adalah agen mutagenik, dan ia dianggap bahawa ia boleh menyebabkan penggantian di pangkalan rantai DNA, melalui pengoksidaan pengoksidaan sitosin dan adenin.
Asid nitrous mempunyai tingkah laku ganda, kerana ia boleh bertindak sebagai agen oksidatif atau sebagai ejen pengurangan; iaitu, ia dapat dikurangkan menjadi no atau n2, mengoksidakan3.
[TOC]
Struktur asid nitrous
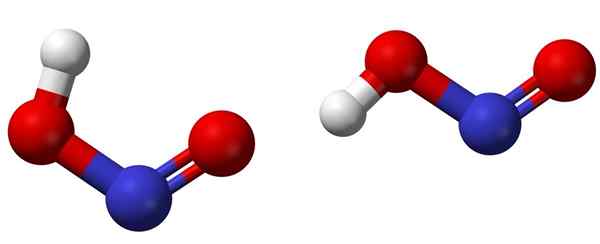 Isomer cis (kiri) dan trans (kanan) dengan struktur molekul masing -masing hno2. Sumber: Ben Mills [Domain Awam].
Isomer cis (kiri) dan trans (kanan) dengan struktur molekul masing -masing hno2. Sumber: Ben Mills [Domain Awam]. Imej atas menunjukkan struktur molekul asid nitrous dengan menggunakan model sfera dan bar. Atom nitrogen (sfera biru) terletak di tengah-tengah struktur, membentuk ikatan berganda (n = O) dan mudah (n-o) dengan atom oksigen (sfera merah).
Perhatikan bahawa atom hidrogen (sfera putih) dikaitkan dengan salah satu oksigen dan tidak langsung ke nitrogen. Jadi, mengetahui ini, formula struktur HNO2 Ia adalah [ho-n = o] atau [tidak (oh)], dan tidak ada pautan h-n seperti (seperti yang boleh difikirkan oleh formula kimia).
Molekul imej sesuai dengan fasa gas; Di dalam air mereka dikelilingi oleh molekul air, yang boleh menerima ion hidrogen (lemah) untuk membentuk ion tidak2- dan h3Sama ada+.
Boleh melayani anda: BeakerStrukturnya boleh mengguna pakai dua bentuk: cis atau trans, yang dipanggil isomer geometri. Dalam isomer cis, atom H dilepaskan dengan atom oksigen jiran; Semasa berada di isomer trans, kedua -duanya terdapat dalam kedudukan anti -opposite.
Dalam isomer cis, pembentukan hidrogen intramolekul (OH-NO) mungkin, yang boleh mengimport intermolecular (onOH-onOH).
Sifat
Nama kimia
-Asid nitrous
-Asid dioksonitrik (III)
-Nitrosile hidroksida
-Hydroxideoxidonitrogen (nama sistematik IUPAC)
Penerangan fizikal
Cecair biru pucat, sepadan dengan penyelesaian nitrit.
Berat molekul
47,013 g/mol.
Pemisahan pemalar
Ia adalah asid lemah. PKAnya adalah 3.35 hingga 25 ºC.
Takat lebur
Hanya dikenali dalam penyelesaian. Oleh itu, titik lebur anda tidak dapat dikira, dan juga kristal anda terpencil.
Takat didih
Dengan tidak ada tulen tetapi di dalam air, pengukuran harta ini tidak tepat. Di satu pihak, ia bergantung kepada kepekatan HNO2, Dan di pihak yang lain, pemanasannya menghasilkan penguraiannya. Itulah sebabnya titik mendidih yang tepat tidak dilaporkan.
Pembentukan jualan
Air larut -larut nitrit dengan li+, Na+, K+, Ac2+, Encik2+, Ba2+. Tetapi, jangan membentuk garam dengan kation serba boleh, seperti: ke3+ dan/atau menjadi2+ (kerana ketumpatan beban yang tinggi). Ia dapat membentuk ester stabil dengan alkohol.
Potensi kebakaran
Ia mudah terbakar untuk tindak balas kimia. Boleh meletup dengan bersentuhan dengan fosforus trichloride.
Penguraian
Ia adalah sebatian yang sangat tidak stabil, dan dalam larutan akueus ia terurai dalam asid nitrik dan asid nitrik:
2 hno2 => Tidak2 + Tidak +h2Sama ada
4 hno2 => 2 hno3 + N2Atau +h2Sama ada
Mengurangkan ejen
Asid nitrous dalam larutan akueus dibentangkan dalam bentuk ion nitrit, tidak2-, yang mengalami beberapa tindak balas pengurangan.
Bertindak balas dengan ion i- dan iman2+, Dalam bentuk kalium nitrit, untuk membentuk oksida nitrik:
2 Kno2 + Ki +h2SW4 => I2 + 2 Tidak +2 jam2Atau +k2SW2
Potassium nitrite dengan kehadiran ion timah dikurangkan untuk membentuk nitrous oksida:
Kno2 + 6 HCl +2 SNCL2 => 2 sncl4 + N2O +3 h2O +2 KCl
Boleh melayani anda: Beryl Hydroxide (Be (OH) 2)Potassium nitrite dikurangkan oleh Zn dalam persekitaran alkali, membentuk ammonia:
5 jam2O +kno2 + 3 Zn => NH3 + KOH +3 Zn (OH)2
Ejen pengoksidaan
Di samping menjadi ejen pengurangan, asid nitrous dapat campur tangan dalam proses pengoksidaan. Contoh.
2 hno2 + H2S => s +2 no +2 h2Sama ada
Hno2 + 3 jam2S => s +nh3 + 2 jam2Sama ada
Asid nitrous, dalam medium pH asid, boleh mengoksidakan ion iodida ke iodin.
Hno2 + Yo- + 6 h+ => 3 i2 + NH3 + 2 jam2Sama ada
Anda juga boleh bertindak sebagai ejen pengurangan yang bertindak di CU2+, menyebabkan asid nitrik.
Nomenclature
Kepada hno2 Anda boleh memberikan nama lain, yang bergantung pada jenis nomenklatur. Asid nitrous sepadan dengan tatanama tradisional; asid dioxonitric (III), kepada tatanama saham; dan dioxonitrate (iii) hidrogen, kepada sistematik.
Sintesis
Asid nitrous boleh disintesis dengan membubarkan trioksida nitrogen di dalam air:
N2Sama ada3 + H2O => 2 hno2
Kaedah penyediaan lain ialah reaksi natrium nitrit, nano3, dengan asid mineral; seperti asid hidroklorik dan asid bromhyteric. Tindak balas dibuat pada suhu rendah dan asid nitrous dimakan di situ.
Abang3 + H+ => Hno2 + Na+
H+ Ia datang sama ada dari HCl atau HBR.
Risiko
Memandangkan sifat dan ciri -cirinya kimianya, terdapat sedikit maklumat mengenai kesan toksik langsung HNO2. Mungkin beberapa kesan berbahaya yang dipercayai dihasilkan oleh kompaun ini, sebenarnya disebabkan oleh asid nitrik, yang boleh berlaku dengan mengurai asid nitrous.
Menunjukkan bahawa hno2 Ia boleh memberi kesan berbahaya pada saluran udara dan dapat menghasilkan gejala kerengsaan pada pesakit asma.
Dalam bentuk natrium nitrit, ia dikurangkan oleh deoxyhemoglobin, menghasilkan oksida nitrik. Ini adalah vasodilator yang kuat yang menghasilkan kelonggaran otot licin vaskular, menganggarkan pada manusia dos LD50 sebanyak 35 mg/kg untuk penggunaan lisan.
Ketoksikan nitrit natrium ditunjukkan dengan keruntuhan kardiovaskular, diikuti oleh hipotensi yang teruk, akibat tindakan vasodilator nitrik oksida, yang dihasilkan dari nitrit.
Nitrogen dioksida, tidak2, Hadir dalam udara yang tercemar (Smog), di bawah keadaan tertentu ia boleh menyebabkan asid nitrous; yang seterusnya dapat bertindak balas dengan amina untuk membentuk nitrosamine, gamma sebatian karsinogenik.
Ia boleh melayani anda: perak oksida (AG2O)Tindak balas yang sama berlaku dengan asap rokok. Sisa -sisa nitrosamine berpegang pada lapisan dalaman kenderaan merokok telah dijumpai.
Aplikasi
Pengeluaran jualan Diazonium
Asid nitrous digunakan dalam industri dalam pengeluaran garam diazonium, melalui reaksinya dengan amina dan fenol aromatik.
Hno2 + Rnah2 + H+ => RNA = nar +h2Sama ada
Garam diazonium digunakan dalam tindak balas sintesis organik; Contohnya, dalam reaksi Sandmeyer. Dalam tindak balas ini penggantian kumpulan amino berlaku (h2N-), dalam amina aromatik utama, oleh kumpulan CL-, Br- dan CN-. Untuk mendapatkan produk aromatik ini, garam coPro diperlukan.
Garam diazonium boleh membentuk sebatian bumbung yang cemerlang yang digunakan sebagai pewarna dan juga berfungsi sebagai ujian kualitatif untuk mengesan kehadiran amina aromatik.
Penghapusan natrium azida
Asid nitrous digunakan untuk menghilangkan natrium azid3), yang berpotensi berbahaya bagi kecenderungannya untuk mengeksploitasi.
2 nan3 + 2 hno2 => 3 n2 + 2 Tidak +2 NaOH
Sintesis Oximas
Asid nitrous boleh bertindak balas dengan kumpulan keton untuk membentuk oximas. Ini boleh dioksidakan untuk membentuk karboksil atau dikurangkan asid untuk menyebabkan amina.
Proses ini digunakan dalam penyediaan komersial asid adipic, monomer yang digunakan dalam pengeluaran nilon. Ia juga campur tangan dalam pengeluaran poliuretana dan esternya adalah plasticizers, terutamanya dalam PVC.
Di bawah bentuk garamnya
Asid nitrous, dalam bentuk natrium nitrit, digunakan dalam rawatan dan pemuliharaan daging; Oleh kerana, ia menghalang pertumbuhan bakteria dan dapat bertindak balas dengan myoglobin, menghasilkan warna merah gelap yang menjadikan daging lebih menarik untuk digunakan.
Garam yang sama digunakan, bersama -sama dengan natrium thiosulfate, dalam rawatan intravena natrium sianida keracunan.
Rujukan
- Graham Solomons t.W., Craig b. Fryhle. (2011). Kimia organik. Amina. (10th Edisi.). Wiley Plus.
- Shiver & Atkins. (2008). Kimia bukan organik. (Edisi Keempat). MC Graw Hill.
- Pubchem. (2019). Asid nitrous. Pulih dari: pubchem.NCBI.NLM.NIH.Gov
- Softschools. (2019). Asid nitrous. Pulih dari: softschools.com
- Wikipedia. (2019). Asid nitrous. Diperoleh dari: dalam.Wikipedia.org
- Persatuan Kimia Diraja. (2015). Asid nitrous. Pulih dari: chemspider.com
- New World Encyclopedia. (2015). Asid nitrous. Pulih dari: newworldyclopedia.org
- DrugBank. (2019). Asid nitrous. Pulih dari: Drugbank.Ac
- Perumusan kimia. (2018). Hno2. Pulih dari: formulasi quimica.com
- « Angka atau petunjuk yang bercakap mengenai kemajuan pendidikan di negara
- Sifat alkil halogenuros, mendapatkan, contoh »

