Hidrolisis Apa yang terdiri dan contoh reaksi
- 713
- 74
- Ms. Micheal Rippin
The Hydrolysis Ini adalah tindak balas kimia yang boleh berlaku dalam molekul atau ion organik dan organik, dan yang melibatkan penyertaan air untuk pecahan bonnya. Namanya berasal dari bahasa Yunani, 'hidro' air, dan 'lisis' pecah.
Molekul air, h2Atau, ia menetapkan keseimbangan dengan ion garam asid dan pangkalan yang lemah, yang muncul untuk kali pertama konsep ini dalam kajian umum kimia dan dalam kimia analisis. Oleh itu, ia adalah salah satu tindak balas kimia yang paling mudah.
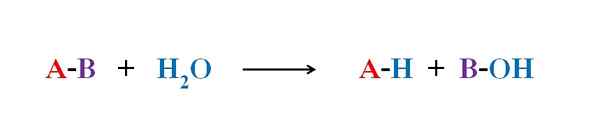 Persamaan umum untuk tindak balas hidrolisis. Sumber: Gabriel Bolívar.
Persamaan umum untuk tindak balas hidrolisis. Sumber: Gabriel Bolívar. Dalam beberapa contoh hidrolisis, air sahaja tidak dapat memecahkan ikatan kovalen tertentu. Apabila ini berlaku, proses itu mempercepatkan atau memangkin oleh pengasidan atau alkali medium; iaitu, dengan kehadiran ion h3Sama ada+ atau oh-, masing -masing. Terdapat juga enzim yang memangkin hidrolisis.
Hydrolysis menduduki tempat istimewa dari segi biomolekul, kerana pautan yang memelihara monomer mereka bersama -sama dengan hydrolyzar di bawah syarat -syarat tertentu. Sebagai contoh, gula dihidrolisiskan untuk mengurai polysaccharides dalam monosakarida konstituen mereka berkat tindakan enzim glucosidase.
[TOC]
Apakah hidrolisis?
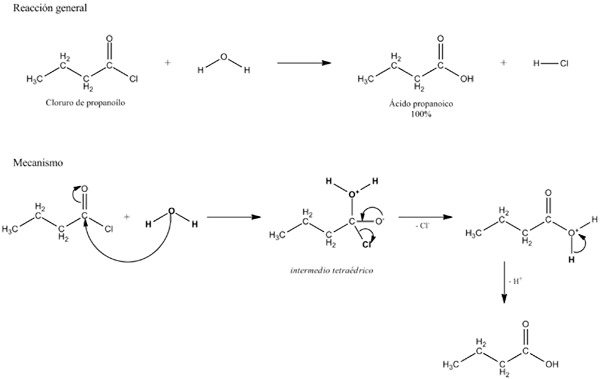
Imej atas menerangkan apa hidrolisis terdiri daripada. Perhatikan bahawa bukan sahaja molekul atau substrat (jika mereka menengahi enzim) memecahkan pautan mereka, tetapi juga air itu sendiri, yang "patah" dalam h+ Dan oh-, Di mana h+ berakhir dengan, dan oh- dengan b. A-B bertindak balas dengan molekul air yang berasal dari dua produk, A-H dan B-OH.
Oleh itu, hidrolisis adalah tindak balas yang bertentangan dengan pemeluwapan. Dalam pemeluwapan dua produk, untuk mengatakan A-H dan B-OH, diikat dengan pembebasan molekul kecil: air. Dalam hidrolisis molekul dimakan, sementara dalam pemeluwapan ia dibebaskan atau dihasilkan.
Ia boleh melayani anda: Kumpulan Carbonyl: Ciri -ciri, Harta, Tatanama, KereaktifanKembali ke contoh gula, katakan bahawa A-B sepadan dengan dimer sukrosa, di mana dia mewakili glukosa, dan fruktosa b. Pautan A-B, Glucosidic boleh menghidrolyzarize untuk berasal dari dua monosakarida secara berasingan dan larutan, dan yang sama berlaku kepada oligo dan polysaccharides jika mereka menengahi enzim dalam reaksi tersebut.
Perhatikan bahawa dalam tindak balas ini, A-B, anak panah hanya mempunyai satu alamat; iaitu, ia adalah hidrolisis yang tidak dapat dipulihkan. Walau bagaimanapun, banyak hidrolisis sebenarnya adalah tindak balas yang boleh diterbalikkan yang mencapai keseimbangan.
Contoh tindak balas hidrolisis
- ATP
ATP stabil antara nilai pH 6.8 dan 7.4. Walau bagaimanapun, pada nilai pH yang melampau ia dihidrolisiskan secara spontan. Dalam makhluk hidup, hidrolisis dipangkin oleh enzim yang dikenali sebagai Atasas:
ATP +H2O => ADP +PI
Tindak balas ini sangat baik, kerana entropi ADP lebih besar daripada ATP. Variasi Tenaga Percuma Gibbs (ΔGº) adalah - 30.5 kJ/mol. Tenaga yang dihasilkan oleh hidrolisis ATP digunakan dalam banyak reaksi Endergon.
Reaksi yang ditambah
Dalam beberapa kes, hidrolisis ATP digunakan untuk penukaran sebatian dalam sebatian (b).
A +ATP +H2Atau b +adp +pi +h+
- Air
Dua molekul air boleh bertindak balas terhadap satu sama lain dalam hidrolisis yang jelas:
H2Atau + h2Atau h3Sama ada+ + Oh-
Seolah -olah salah satu daripada molekul air yang patah dalam h+ Dan oh-, akan menghubungkan h+ Kepada atom oksigen molekul air yang lain, yang menyebabkan ion hidrium, h, h3Sama ada+. Reaksi ini, lebih daripada hidrolisis, adalah mengenai diri -propotolisis air.
Boleh melayani anda: tenaga pengaktifan- Protein
Protein adalah makromolekul yang stabil dan untuk mencapai hidrolisis lengkap mereka, dalam asid amino yang membentuknya, keadaan yang melampau diperlukan; seperti kepekatan asid hidroklorik (6 m) dan suhu tinggi.
Walau bagaimanapun, makhluk hidup dikurniakan senjata enzimatik yang membolehkan hidrolisis protein dalam asid amino dalam duodenum. Enzim yang terlibat dalam pencernaan protein hampir dirembeskan sepenuhnya oleh pankreas.
Terdapat enzim exopeptidase yang merendahkan protein, bermula pada hujungnya: aminopeptidase melalui ujung amino, dan carboxypeptidase melalui ujung karboksil. Enzim endopeptidase menggunakan tindakan mereka di dalam rantaian protein, contohnya: tripsin, pepsin, chimotripsin, dll.
- Amidas dan ester
Amida apabila dipanaskan dalam medium alkali berasal dari asid karboksilik dan amina:
Rconh2 + H2O => rcoo- + NH2
Abeats dalam medium berair dihidrolisiskan dalam asid karboksilik dan alkohol. Proses ini dipangkin sama ada oleh asas atau asid:
Rco-atau ' +h2O => rcooh +r'oh
Ini adalah reaksi saponifikasi yang terkenal.
- Asid-asas
Di dalam air, beberapa spesies dihidrolisiskan untuk mengasingkan atau alkali persekitaran berair.
Penambahan garam asas
Natrium asetat, garam asas, memisahkan air yang memberi ion+ (natrium) dan Cho3COO- (asetat). Asasnya adalah kerana asetat dihidrolisiskan untuk menjana ion oh-, Walaupun natrium tetap tidak berubah:
Ch3COO- + H2Atau ch3COOH +OH-
Ia dapat melayani anda: metil salisilatOh- Dia bertanggungjawab untuk pH untuk meningkatkan dan menjadi asas.
Penambahan garam asid
Ammonium klorida (NH4CL) dibentuk oleh ion klorida (CL-) dari asid hidroklorik (HCl), asid kuat, dan kation ammonium (NH4+) dari ammonium hidroksida (NH4Oh), asas yang lemah. Cl- Ia tidak memisahkan air, tetapi kation ammonium berubah menjadi air dengan cara berikut:
NH4+ + H2Atau NH3 + H3Sama ada+
Hidrolisis kation ammonium menghasilkan proton yang meningkatkan keasidan medium berair, jadi disimpulkan bahawa NH4CL adalah garam asid.
Penambahan garam neutral
Natrium klorida (NaCl) adalah produk garam tindak balas asas yang kuat (NaOH) dengan asid kuat (HCl). Apabila membubarkan natrium klorida di dalam air, natrium kation dihasilkan (na+) dan anion (cl-). Kedua -dua ion tidak berpisah di dalam air, jadi mereka tidak menambah h+ atau oh-, Menjaga pH anda tetap.
Oleh itu, dikatakan bahawa natrium klorida adalah garam neutral.
Rujukan
- Mathews, c. K., Van holde, k. Dan. Dan ahern, k. G. (2002). Biokimia. (Edisi ketiga). Edit. Pearson-Addison Wesley.
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (8th ed.). Pembelajaran Cengage.
- Helmestine, Anne Marie, Ph.D. (13 Januari 2019). Hidrolisis: Definisi dan Contohnya. Pulih dari: Thoughtco.com
- Theresa Phillips. (28 April 2019). Penjelasan mengenai proses hidrolisis. Pulih dari: theBalance.com
- Editor enyclopaedia Britannica. (16 November 2016). Hydrolysis. Encyclopædia Britannica. Pulih dari: Britannica.com
- Wikipedia. (2019). Hydrolysis. Diperoleh dari: dalam.Wikipedia.org
- « Hyracotherium Ciri -ciri, Pemakanan, Spesies, Pembiakan
- Sejarah Permainan Video Asal ke Realiti Maya »

