Kalsium hidroksida (Ca (OH) 2) Struktur, sifat, mendapatkan, menggunakan

- 4692
- 649
- Ms. Santos Fritsch
Dia Kalsium hidroksida Ia adalah sebatian bukan organik yang formula kimia adalah Ca (OH)2. Ia adalah serbuk putih yang telah digunakan selama beribu -ribu tahun, di mana ia telah memenangi beberapa nama tradisional atau nama samaran; Di antara mereka, kita boleh menyebutkan yang membosankan, mati, kimia, terhidrat atau halus.
Secara semula jadi ia boleh didapati di mineral yang banyak dipanggil Portlandita, dengan warna yang sama. Kerana ini CA (oh)2 Ia tidak diperoleh secara langsung dari mineral ini, tetapi dari rawatan haba, diikuti dengan penghidratan, batu kapur. Ini diperolehi oleh kapur, cao, yang kemudiannya dimatikan atau melembapkan untuk menghasilkan CA (OH)2.
 Sampel padat kalsium hidroksida. Sumber: ChemicalInterest [Domain Awam]
Sampel padat kalsium hidroksida. Sumber: ChemicalInterest [Domain Awam] CA (oh)2 Ia adalah asas yang agak lemah di dalam air, kerana ia hampir tidak dapat dibubarkan dalam air panas; Tetapi kelarutannya meningkat dalam air sejuk, kerana penghidratannya adalah eksotermik. Walau bagaimanapun, asasnya terus menjadi alasan untuk berhati -hati dengannya semasa manipulasinya, kerana ia boleh menyebabkan luka bakar di mana sahaja di dalam badan.
Ia telah digunakan sebagai pengawal selia pH untuk bahan atau makanan yang berbeza, selain menjadi sumber kalsium yang baik berkenaan dengan jisimnya. Ia mempunyai aplikasi dalam industri kertas, dalam pembasmian kumbahan, dalam produk yang meniru, dalam barangan runcit yang diperbuat daripada jagung jagung.
Walau bagaimanapun, penggunaannya yang paling penting adalah sebagai bahan binaan, kerana kapur terhidrasi apabila bercampur dengan bahan -bahan lain plaster atau mortar. Dalam campuran yang keras ini, CA (OH)2 Menyerap karbon dioksida udara untuk menyatukan kristal pasir bersama -sama dengan kalsium karbonat terbentuk.
Pada masa ini penyelidikan masih dijalankan dengan tujuan untuk membangunkan bahan binaan yang lebih baik yang mempunyai CA (OH)2 secara langsung dalam komposisinya sebagai nanopartikel.
[TOC]
Struktur
Kristal dan ionnya
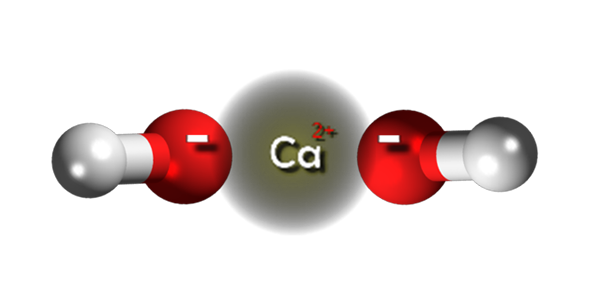 Ion kalsium hidroksida. Sumber: Claudio Pistilli [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)]
Ion kalsium hidroksida. Sumber: Claudio Pistilli [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)] Dalam imej atas kita mempunyai ion yang mengintegrasikan kalsium hidroksida. Formula CA yang sama (OH)2 menunjukkan bahawa untuk setiap kation ca2+ Terdapat dua anion oh- yang berinteraksi dengannya dengan tarikan elektrostatik. Hasilnya ialah kedua -dua ion akhirnya mewujudkan kristal struktur heksagon.
Dalam kristal heksagon seperti CA (OH)2 Ion -ion sangat dekat antara satu sama lain, yang memberikan penampilan sebagai struktur polimer; Walaupun tidak ada secara rasmi ikatan kovalen CA-O masih diberikan perbezaan elektronegativiti yang luar biasa antara kedua-dua elemen.
 Struktur kalsium hidroksida
Struktur kalsium hidroksida Strukturnya menjana octaedros cao6, iaitu, CA2+ berinteraksi dengan enam oh- (AC2+-Oh-).
Ia boleh melayani anda: lithium hidroksida (lioh)Satu siri octahedra ini membentuk lapisan kaca, yang boleh berinteraksi dengan yang lain oleh jambatan hidrogen yang mengekalkannya secara intermolecularly cohesive; Walau bagaimanapun, interaksi ini memudar pada suhu 580 ºC, apabila CA (OH) dehidrasi2 ke cao.
Di sisi tekanan tinggi, tidak banyak maklumat mengenainya, walaupun kajian mengesahkan bahawa pada tekanan 6 GPa kaca heksagon mengalami peralihan dari heksagon ke fasa monoklinik; Dan dengan ini, ubah bentuk Octaedros Cao6 dan lapisannya.
Morfologi
Kristal CA (OH)2 Mereka adalah heksagon, tetapi itu bukan halangan bagi mereka untuk mengamalkan morfologi. Beberapa struktur ini (helai, serpihan atau batu) lebih berliang daripada yang lain, teguh atau rata, yang secara langsung mempengaruhi aplikasi akhir mereka.
Oleh itu, ia tidak sama menggunakan kristal dari Mineral Portland, daripada mensintesisnya supaya mereka terdiri daripada nanopartikel di mana beberapa parameter yang ketat diikuti; seperti tahap penghidratan, kepekatan CaO yang digunakan, dan masa yang dibenarkan untuk menanam kaca.
Sifat
Penampilan fizikal
Pepejal putih, tandas, dan rasa pahit pepejal.
Jisim molar
74,093 g/mol
Takat lebur
580 ºC. Pada suhu ini ia memecah melepaskan air, jadi tidak pernah sampai ke penguapan:
CA (oh)2 => Cao + h2Sama ada
Ketumpatan
2,211 g/cm3
Ph
Penyelesaian berair yang berair mempunyai pH 12.4 hingga 25 ºC.
Kelarutan air
Kelarutan CA (OH)2 Dalam air berkurangan dengan peningkatan suhu. Sebagai contoh, pada 0 ºC kelarutannya ialah 1.89 g/l; manakala pada 20 ºC dan 100 ºC, ini masing -masing 1.73 g/l dan 0.66 g/l.
Ini menunjukkan fakta termodinamik: penghidratan CA (OH)2 Ia adalah eksotermik, jadi mematuhi prinsip Le Catelier persamaannya:
CA (oh)2 Ac2+ + 2OH- + Q
Di mana haba dilepaskan. Lebih panas air, keseimbangan akan lebih cenderung ke kiri; iaitu, CA (OH) akan membubarkan kurang2. Oleh sebab itu, dalam air sejuk melarutkan lebih banyak daripada air mendidih.
Sebaliknya, kelarutan ini meningkat jika pH menjadi asid, disebabkan peneutralan ion OH- dan untuk anjakan keseimbangan sebelumnya ke kanan. Semasa proses ini lebih banyak haba dilepaskan daripada air neutral. Sebagai tambahan kepada penyelesaian berair berasid, CA (OH)2 Ia juga larut dalam gliserol.
K$
5.5 · 10-6. Nilai ini dianggap kecil dan bersetuju dengan kelarutan rendah CA (OH)2 Di dalam air (baki yang sama di atas).
Boleh melayani anda: logamIndeks refraktif
1,574
Kestabilan
CA (oh)2 Ia tetap stabil selagi ia tidak terdedah kepada co2 udara, kerana ia menyerapnya dan membentuk kalsium karbonat, caco3. Oleh itu, ia mula tidak digalakkan dalam campuran pepejal kristal Ca (OH)2-Pencuri3, Di mana terdapat anion co32- bersaing dengan oh- Untuk berinteraksi dengan CA2+:
CA (oh)2 + Co2 => Caco3 + H2Sama ada
Malah, inilah sebab mengapa penyelesaian tertumpu CA (OH)2 Mereka menghidupkan katil, sebagai penggantungan zarah Caco muncul3.
Memperoleh
CA (oh)2 Ia diperolehi secara komersil dengan bertindak balas dengan kapur, CAO, dengan lebihan dua hingga tiga kali air:
Cao + h2O => ca (oh)2
Walau bagaimanapun, karbonisasi Ca (OH) boleh berlaku dalam proses2, Sama seperti yang dijelaskan di atas.
Kaedah lain untuk mendapatkannya terdiri daripada menggunakan garam kalsium larut, seperti klik2 atau CA (tidak3)2, dan mendasarkan mereka dengan NaOH, supaya CA (OH) bergegas2. Mengawal parameter seperti jilid air, suhu, pH, pelarut, tahap karbonisasi, masa pematangan, dll., Nanopartikel dengan morfologi yang berbeza boleh disintesis.
Ia juga boleh disediakan dengan memilih bahan mentah yang semula jadi dan boleh diperbaharui, atau pembaziran industri, yang kaya dengan kalsium, yang apabila abu mereka dipanaskan dan diproses akan terdiri daripada kapur; Dan dari sini, sekali lagi, CA (OH) dapat disediakan2 Dengan menghidratkan abu ini tanpa perlu membazirkan batu kapur, Caco3.
Sebagai contoh, Bagazo del Agave telah digunakan untuk tujuan ini, memberikan nilai tambah kepada pembaziran industri tequila.
Aplikasi
Rawatan makanan
 Acar pertama kali direndam dalam kalsium hidroksida untuk menjadi lebih rangup. Sumber: Pixabay.
Acar pertama kali direndam dalam kalsium hidroksida untuk menjadi lebih rangup. Sumber: Pixabay. Kalsium hidroksida hadir dalam banyak makanan di beberapa peringkat penyediaannya. Sebagai contoh, dalam larutan berair, acar direndam, seperti timun, untuk menjadikannya lebih renyah ketika membungkusnya dalam cuka. Ini kerana protein permukaan mereka menyerap kalsium di tengah.
Begitu juga dengan bijirin jagung sebelum mengubahnya menjadi tepung, kerana ia membantu melepaskan vitamin B3 (Niacina) dan memudahkan pengisarannya. Kalsium yang disediakan juga digunakan untuk menambah nilai pemakanan kepada jus tertentu.
CA (oh)2 Anda juga boleh mengganti serbuk penaik dalam beberapa resipi roti, dan menjelaskan penyelesaian gula -gula dari tebu dan bit.
Pembasmian kumbahan
Tindakan klasifikasi CA (OH)2 Ia adalah kerana ia bertindak sebagai ejen flocculant; iaitu saiz zarah yang digantung meningkat untuk membentuk flocculus, yang kemudiannya sedimen atau boleh ditapis.
Boleh melayani anda: Pauling ScaleHarta ini telah digunakan untuk membasmi kumbahan, menjejaskan koloidnya yang tidak menyenangkan dalam pandangan (dan bau) penonton.
Industri Kertas
CA (oh)2 Ia digunakan dalam proses Kraft untuk menjana semula NaOH yang digunakan untuk merawat kayu.
Penyerap gas
CA (oh)2 Ia digunakan untuk menghilangkan co2 ruang tertutup atau di persekitaran di mana kehadiran mereka tidak produktif.
Penjagaan diri
Dalam formulasi untuk krim depilasi CA (OH)2 Ia diam -diam, kerana asasnya membantu dalam kelemahan keratin rambut, dan oleh itu, lebih mudah untuk menghapuskannya.
Pembinaan
 Kalsium hidroksida adalah sebahagian daripada struktur kerja pembinaan lama seperti piramid Mesir. Sumber: Pexels.
Kalsium hidroksida adalah sebahagian daripada struktur kerja pembinaan lama seperti piramid Mesir. Sumber: Pexels. CA (oh)2 Beliau telah hadir sejak zaman dahulu lagi mengintegrasikan massa plaster dan mortar yang digunakan dalam pembinaan karya seni bina Mesir seperti piramid; Juga bangunan, makam, dinding, tangga, lantai, sokongan, dan juga untuk membina semula simen pergigian.
Tindakan kuatnya disebabkan oleh fakta bahawa dengan "bernafas" CO2, Kristal yang terhasil daripada Caco3 Pasir dan komponen lain dari campuran tersebut berakhir dengan tahap yang lebih baik.
Risiko dan kesan sampingan
CA (oh)2 Ia bukan pepejal yang sangat asas berbanding dengan hidroksida lain, walaupun lebih daripada MG (OH)2. Walaupun begitu, walaupun tidak reaktif atau mudah terbakar, asasnya masih cukup agresif untuk menyebabkan sedikit luka bakar.
Oleh itu, ia mesti dimanipulasi dengan hormat, kerana ia dapat merengsakan mata, lidah dan paru -paru, selain mencetuskan penyakit lain seperti: kehilangan penglihatan, alkalinization yang teruk darah, ruam kulit, muntah dan sakit tekak.
Rujukan
- Shiver & Atkins. (2008). Kimia bukan organik. (Edisi Keempat). MC Graw Hill.
- Wikipedia. (2019). Kalsium hidroksida. Diperoleh dari: dalam.Wikipedia.org
- Chávez Guerrero et al. (2016). Sintesis dan pencirian kalsium hidroksida yang diperolehi dari begasse agave dan penyelidikan aktiviti antibakteria. Pulih dari: Scielo.org.mx
- Riko Iizuka, Takehiko Yagi, Kazuki Komatsu, Hirotada Gotou, Taku Tsuchiya, Keiji Kusaba, Hiroyuki Kagi. (2013). Struktur kristal fasa tekanan tinggi kalsium hidroksida, portlandit: pada serbuk situ dan kajian difffraction sinar-X tunggal kristal. Mineralogi Amerika; 98 (8-9): 1421-1428. Doi: doi.org/10.2138/AM.2013.4386
- Hans Lohninger. (5 Jun, 2019). Kalsium hidroksida. Kimia Librettexts. Pulih dari: chem.Libretxts.org
- Aniruddha s. et al. (2015). Sintesis kalsium hidroksida nano dalam medium penderitaan. Persatuan Seramik Amerika. doi.org/10.1111/Jace.14023
- Carly VanderGrindt. (12 April 2018). Bagaimana kalsium hidroksida digunakan dalam makanan, dan adakah ia selamat? Pulih dari: kesihatan.com
- Brian Clegg. (26 Mei 2015). Kalsium hidroksida. Pulih dari: dunia kimia.com

