Struktur, sifat, penggunaan, sintesis natrium natrium sodium

- 3450
- 897
- Erick Krajcik
Dia natrium hidroksida Ia adalah sebatian bukan organik yang formula kimianya adalah NaOH dan terdiri daripada asas logam yang sangat kuat atau alkali. Penyelesaian 5 %di dalam air mempunyai pH hampir 14.
Ia adalah pepejal putih yang sangat hygroscopic dan yang juga boleh menyerap karbon dioksida udara untuk membentuk natrium karbonat. Secara komersil datang dalam botol plastik seperti pil, yang tidak boleh didedahkan terlalu banyak masa di udara, dan tidak harus dimanipulasi dengan spatula.
 Pil sodium hidroksida pada kaca jam. Sumber: Tiada pengarang yang boleh dibaca mesin yang disediakan. Walkerma diasumsikan (berdasarkan tuntutan hak cipta). [Domain awam]
Pil sodium hidroksida pada kaca jam. Sumber: Tiada pengarang yang boleh dibaca mesin yang disediakan. Walkerma diasumsikan (berdasarkan tuntutan hak cipta). [Domain awam] Natrium hidroksida boleh disintesis apabila bertindak balas kalsium hidroksida dengan natrium karbonat. Pada masa ini, ia secara asasnya disintesis oleh elektrolisis air garam, dan merupakan produk sekunder pengeluaran klorin gas.
Memberi. Ia juga digunakan dalam pembersihan rumah, rawatan air, pemprosesan aluminium, pembuatan ubat, dll.; Dan di atas semua, ia adalah kecemerlangan corak sekunder.
Natrium hidroksida sangat mengakis, dapat menghasilkan kerengsaan dan luka kulit dan mata. Dengan penyedutan habuknya, ia boleh menyebabkan edema pulmonari. Sementara itu, pengambilannya boleh menyebabkan kecederaan serius ke saluran pencernaan yang boleh menyebabkan kematian.
[TOC]
Struktur
Anhydrous
 Ion NaOH. Sumber: Gabriel Bolívar.
Ion NaOH. Sumber: Gabriel Bolívar. Imej unggul menunjukkan ion yang membentuk naoh. Na kation+ Ia diwakili oleh sfera ungu, manakala anion hidroksil (hidroksida atau oxydril) oh- Untuk sfera merah dan putih. Kedua -dua ion na+ Dan oh- Mereka berinteraksi antara satu sama lain oleh tarikan elektrostatik beban bertentangan mereka.
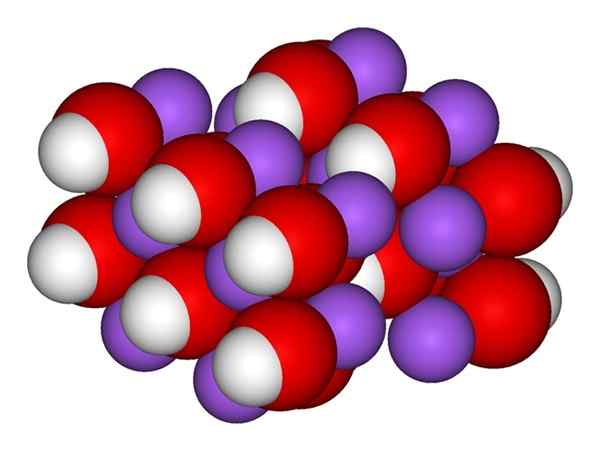 Struktur natrium hidroksida
Struktur natrium hidroksida Interaksi sedemikian tidak beralasan, jadi tarikan na ionik+Oh- boleh menjejaskan orang lain pada jarak tertentu. Hasilnya ialah ion na+ Mereka menangkis satu sama lain, dengan cara yang sama seperti oh-, sehingga menentukan kristal tenaga minimum di mana mereka menubuhkan struktur teratur dan berkala (kristal).
Oleh itu muncul kristal ortorrombik NaOH anhydro (tanpa air):
 Perwakilan struktur kristal natrium hidroksida anhydrous. Sumber: Quibik melalui Wikipedia.
Perwakilan struktur kristal natrium hidroksida anhydrous. Sumber: Quibik melalui Wikipedia. Ion tetap cukup kohesif untuk kristal anhydrous NaOH ke pangkalan 323 ºC (dengan syarat tidak ada kelembapan di alam sekitar).
Menghidrat
Kedua -dua Na+ Suka oh- Mereka adalah ion bahawa molekul air solvetan (hidrat) dengan mudah. Ini menyukai penghidratannya di atas tenaga retikular kristalnya, jadi NaOH mengeluarkan banyak tenaga ketika bersentuhan dengan air.
Ia boleh melayani anda: reaksi fehling: persediaan, ejen aktif, contoh, kegunaanWalau bagaimanapun, kristal anhydrous boleh menjadi tuan rumah molekul air tanpa membubarkan; iaitu, natrium hidroksida boleh membentuk banyak hidrat, NaOH · NH2Sama ada. Molekul air mungkin membentuk jambatan hidrogen dengan oh- (Hoh-oh-), atau menyelaras dengan NA+ (NA+-Oh2).
Bergantung pada perkadaran molar antara NaOH dan H2Atau, monohidrat boleh timbul (naOH · h2O), dihydrates (naOH · 2h2O), Trihemacrates (NaOH · 3.5h2O), tetrahydrates (NaOH · 4H2O), Heptahridates (NaOH · 7H2O), dan lain -lain.
Setiap hidrat ini dapat mengkristal dari larutan NaOH berair dengan peratusan jisim yang berbeza dan pada suhu yang berbeza. Oleh itu, NaOH mempamerkan gambarajah kelarutan air yang rumit.
Secara umum, kristal menghidrat kurang padat dan mempunyai titik lebur yang lebih rendah. Ini kerana molekul air "menghalang" interaksi antara NA+ Dan oh-, Menambah kuasa dipole-dipole dalam pengorbanan tarikan ionik.
Sifat fizikal dan kimia
Nama
Nama pilihan IUPAC: Natrium hidroksida. Nama Lain: Soda Kaustik, Ascarita (kurang biasa)
Jisim molar
39,9971 g/mol
Penampilan
Kristal pepejal atau putih, serous atau legap.
Takat lebur
323 ºC
Takat didih
1.388 ºC
Kelarutan air
1.000 g/l pada suhu 25 ºC. Ini menunjukkan berapa banyak yang dapat dibubarkan di dalam air.
Penyelesaian berairnya likat, dengan nilai kelikatan berhampiran delapan puluh kali lebih besar daripada air, dan melepaskan sangat panas pada mulanya. Sekiranya anda mempunyai hubungan dengan mereka, mereka menghidupkan kulit licin, kerana saponifikasi asid lemak kulit.
Asas (PKB)
- 0.56
Ph
Penyelesaian P/P 5 % di dalam air mempunyai pH hampir 14
Indeks Pembiasan (ND)
Pada panjang gelombang 580.4 nm: 1,433 hingga 320 ºC, dan 1,421 hingga 420 ° C.
Kestabilan
Bekas yang mengandungi ia mesti ditutup dengan ketat untuk mengelakkan pembentukan natrium karbonat. Ini disebabkan oleh hygroscopicity yang tinggi, yang menyebabkannya menyerap kelembapan persekitarannya dan kontentnya2.
Penguraian
Apabila dipanaskan hingga penguraian mengeluarkan asap dari natrium oksida.
Titik arah diri
Ia tidak mudah terbakar
Goo
4.0 cpoise pada 350 ºC
Haba pengewapan
175 kJ/mol a 1.388 ºC
Ketegangan permukaan
74.35 Dynas/cm dalam penyelesaian 2.72 % P/P dalam air pada 18 ° C.
Reaktiviti
Dengan asid
Bertindak balas dengan asid mineral organik dan bukan organik, menyebabkan air dan garam yang sepadan. Dalam kes asid sulfurik, tindak balasnya adalah eksotermik.
Boleh melayani anda: aluminium sulfida (Al2S3): struktur, sifat, kegunaan2 NaOH+H2SW4 => Na2SW4 + 2 jam2Sama ada
Dengan oksida asid
Bereaksi dengan sulfur dioksida, sebagai contoh, memberikan garam sulfit dan air:
2 NaOH +So2 => Na2SW3 + H2Sama ada
Dengan logam
Penyelesaian berair bertindak balas dengan beberapa logam untuk menyebabkan garam natrium kompleks. Sebagai contoh, reaksinya dengan zink menimbulkan natrium zincato:
Zn + 2 NaOH + 2 jam2O => na2[Zn (OH)4] + H2
Sintesis
Natrium hidroksida terutamanya disintesis oleh dua kaedah: penggunaan natrium karbonat, pada mulanya digunakan, dan elektrolisis natrium klorida, yang kini menggunakan industri yang lebih besar.
Tindak balas natrium karbonat dan kalsium hidroksida
Natrium karbonat bereaksi dengan kalsium hidroksida dalam proses yang dikenali sebagai pembasmian:
CA (oh)2 + Na2Co3 => Caco3 + NaOH
Kalsium karbonat mendahului, meninggalkan natrium hidroksida dalam supernatan, yang tertumpu oleh penyejatan.
Natrium karbonat sebelum ini berasal dari proses solvay:
2 NaCl+ Caco3 => Na2Co3 + CACL2
Elektrolisis natrium klorida
Elektrolisis natrium klorida, yang terdapat dalam air garam, menghasilkan gas hidrogen, gas klorida dan natrium hidroksida dalam larutan akueus:
2 NaCl+2 jam2O => h2 + Cl2 + 2 NaOH
Ruang elektrolitik terdiri daripada petak di mana anod (+), logam titanium, dan tapak di mana air garam diletakkan. Petak ini dipisahkan dari petak katod (-) menggunakan membran berliang.
Reaksi berikut berlaku di anod:
2 Cl- => Cl2 + 2 e- (pengoksidaan)
Sementara itu, tindak balas ini berlaku di katod:
2 jam2O +2 e- => H2 + Oh- (pengurangan)
Natrium (na+) meresap dari petak anod ke katod, melalui membran yang memisahkannya, membentuk natrium hidroksida.
Aplikasi
Produk pembersihan
Natrium hidroksida digunakan untuk pembuatan sabun dan detergen yang digunakan di rumah dan dalam aktiviti komersial. Gabungan natrium dan klorin hidroksida menghasilkan peluntur klorin, digunakan dalam mencuci pakaian putih.
Ia juga menghapuskan pengumpulan lemak di longkang, menghasilkan penghapusannya melalui penukarannya ke dalam sabun melalui proses saponifikasi. Ini membolehkan penghapusan halangan paip rumah dan bangunan lain.
Produk farmaseutikal dan perubatan
Natrium hidroksida digunakan dalam penjelasan analgesik biasa, seperti aspirin. Juga ubat -ubatan dengan tindakan antikoagulan yang menghalang pembentukan bekuan darah dan ubat -ubatan untuk mengurangkan hiperkolesterolemia.
Proses tenaga
Natrium hidroksida digunakan dalam pembuatan sel bahan api yang berfungsi sebagai bateri untuk menghasilkan elektrik untuk pelbagai aplikasi, termasuk pengangkutan. Resin epoksi, yang dihasilkan dengan campur tangan natrium hidroksida, digunakan dalam turbin angin.
Ia boleh melayani anda: kakisan galvanik: mekanisme, contoh, perlindunganRawatan air
Natrium hidroksida digunakan untuk meneutralkan keasidan air dan menyumbang kepada penghapusan logam beratnya. Ia juga digunakan untuk pengeluaran natrium hipoklorit, disinfektan air.
Natrium hidroksida bertindak balas dengan aluminium sulfat untuk pembentukan aluminium hidroksida: agen flocculant yang digunakan dalam loji rawatan air untuk meningkatkan pemendapan zarah, menghasilkan penjelasannya.
Pembuatan kertas
Natrium hidroksida digunakan dengan natrium sulfida dalam rawatan kayu untuk mendapatkan selulosa, dengan cara yang hampir murni, yang membentuk asas kertas. Ia juga digunakan dalam kitar semula kertas, kerana dengan membantu memisahkan dakwat, ia membolehkan kita menggunakannya lagi.
Pembuatan Perindustrian
Natrium hidroksida digunakan dalam pembuatan Rayón, Spandex, Letupan, Resin Epoksi, Kaca dan Seramik. Ia digunakan dalam industri tekstil untuk pewarna, dan memproses kain kapas.
Dalam loji rawatan tebu, natrium hidroksida suhu rendah digunakan untuk pengeluaran tebu bagazo.
Risiko
Natrium hidroksida adalah sebatian yang sangat menghakis, jadi ia boleh menyebabkan, dengan bersentuhan dengan kulit, luka bakar, ampul dan bahkan parut kekal.
Bersentuhan dengan mata, ia dapat menghasilkan luka bakar yang serius, bengkak, kesakitan, penglihatan kabur, dan dalam kes yang teruk, ia boleh menyebabkan kebutaan kekal.
Pengambilan natrium hidroksida boleh menyebabkan terbakar ke bibir, lidah, tekak, esofagus dan perut. Antara gejala biasa, mual, muntah, kekejangan perut dan cirit -birit ditunjukkan.
Walaupun penyedutan natrium hidroksida jarang berlaku, dan hanya boleh berlaku kerana kehadiran habuk kompaun di udara atau dengan pembentukan embun yang mengandunginya, ia menghasilkan kerengsaan di paru -paru.
Sekiranya pendedahan kronik, ini boleh menyebabkan edema paru -paru dan pemendekan pernafasan teruk, yang merupakan kecemasan perubatan.
Rujukan
- Shiver & Atkins. (2008). Kimia bukan organik. (Edisi Keempat). MC Graw Hill.
- Wikipedia. (2019). Natrium hidroksida. Diperoleh dari: dalam.Wikipedia.org
- Pusat Kebangsaan Maklumat Bioteknologi. (2019). Natrium hidroksida. Pangkalan data PUBCHEM. CID = 14798. Pulih dari: pubchem.NCBI.NLM.NIH.Gov
- Elemen Amerika. (2019). Penyelesaian sodium hidroksida. Diperolehi daripada: Americanements.com
- Fakta Keselamatan Kimia. (2019). Natrium hidroksida. Pulih dari: bahan kimia.org
- Kesihatan NJ. (2015). Natrium hidroksida. [Pdf]. Pulih dari: NJ.Gov
- Pusat Kesihatan & Keselamatan Pekerjaan Kanada. (2019). OSH Jawapan Lembaran Fakta: Natrium Hidroksida. Pulih dari: COHS.Ac
- Ausetute. (s.F.). Pengeluaran natrium hidroksida dan klorin oleh elektrolisis. Pulih dari: ausetute.com.Au
- « Asal bahasa chol, ciri -ciri, di mana anda bercakap, kata -kata
- Ciri -ciri Majalah Diindeks, Kriteria, Contoh Berpengaruh »

