Holmio

- 5016
- 382
- Ms. Micheal Rippin
 Sampel Ultrapure Holm logam. Sumber: Hi-Res Imej Elemen Kimia [CC oleh 3.0 (https: // creativeCommons.Org/lesen/oleh/3.0)]
Sampel Ultrapure Holm logam. Sumber: Hi-Res Imej Elemen Kimia [CC oleh 3.0 (https: // creativeCommons.Org/lesen/oleh/3.0)] Apa itu Holmio?
Dia Holmio Ia adalah elemen logam yang dimiliki oleh blok F dari jadual berkala, khususnya hingga tempoh lantanida. Oleh itu, ia adalah ahli bumi nadir, bersebelahan dengan Erbio, iTrio, Disposio dan Iterbio. Semua ini membentuk satu siri mineral (XenoTima atau Gadolinita) yang sukar dipisahkan melalui kaedah kimia konvensional.
Simbol kimianya adalah Ho, mempunyai bilangan atom 67, dan kurang banyak daripada jirannya disposio (66Dy) dan Erbio (68Er). Kemudian dikatakan bahawa pemerintahan Oddo-Harkins mematuhi. Holmius adalah salah satu daripada logam yang jarang berlaku yang hampir tidak ada yang tahu atau mengesyaki kewujudannya; Malah di kalangan bahan kimia, biasanya tidak disebutkan dengan kerap.
Dalam bidang perubatan, Holmio terkenal dengan penggunaan lasernya dalam pembedahan untuk memerangi patologi prostat. Ia juga mewakili bahan yang menjanjikan untuk pembuatan elektromagnet dan komputer kuantum, kerana sifat magnetnya yang luar biasa.
Sebatian Holmium, Trivalen, Ho3+, Mereka membentangkan keanehan mempamerkan warna yang bergantung kepada cahaya yang mereka iradie. Sekiranya ini adalah pendarfluor, warna sebatian ini berubah dari kuning ke merah jambu. Begitu juga, ia berlaku dengan penyelesaiannya.
Sejarah
Penemuan Holmio disebabkan oleh dua bahan kimia Switzerland, Marc Defontaine dan Jacques-Louis Soret, yang pada tahun 1878 dikesan secara spektroskopi semasa menganalisis dalam mineral Geneva dari nadir bumi. Mereka memanggilnya elemen x.
Hanya setahun kemudian, pada tahun 1879, ahli kimia Sweden per Teodor Cleve berjaya2Sama ada3). Oksida ini, yang tercemar oleh kekotoran lain, menunjukkan pewarna coklat, yang dinamakannya 'Holmia', yang bermaksud strok dalam bahasa Latin.
Boleh melayani anda: reaksi exergonik: ciri dan contohJuga, Cleve memperoleh bahan hijau yang lain: 'Thulia', yang menjadi Tulio Oxide. Masalah penemuan ini adalah bahawa tiada satu pun dari tiga bahan kimia yang dapat memperoleh sampel yang cukup murni dari oksida Holm, kerana ia tercemar oleh atom dok, satu lagi logam lanthanide.
Tidak lain tetapi pada tahun 1886 bahawa kimia Perancis, Paul Lecoq dari Boisbaudran, mengasingkan Holm Oxide oleh pemendakan yang dikecilkan. Oxide ini kemudiannya menjalani tindak balas kimia untuk menghasilkan garam holmio, yang dikurangkan pada tahun 1911 oleh ahli kimia Sweden Otto Holmberg; Dan sebagainya, sampel Holm logam pertama muncul.
Walau bagaimanapun, pada masa ini ion Holmio, Hol3+, Mereka diekstrak oleh kromatografi pertukaran ion, bukannya menggunakan reaksi konvensional.
Holm Properties
 Lokasi Holmio dalam jadual berkala. Sumber: Vektorisasi: Sushant Savla 05:51, 9 Jun 2019 (UTC), CC BY-SA 4.0, melalui Wikimedia Commons
Lokasi Holmio dalam jadual berkala. Sumber: Vektorisasi: Sushant Savla 05:51, 9 Jun 2019 (UTC), CC BY-SA 4.0, melalui Wikimedia Commons Penampilan fizikal
Logam perak, lembut, mulur dan lembut.
Nombor atom
67 (67Ho)
Jisim molar
164.93 g/mol
Takat lebur
1461 ºC
Takat didih
2600 ºC
Ketumpatan
Pada suhu bilik: 8.79 g/cm3
Hanya apabila cair atau cair: 8.34 g/cm3
Haba Fusion
17 kJ/mol
Haba pengewapan
251 kJ/mol
Kapasiti haba molar
27.15 J/(mol · k)
Elektronegativiti
1.23 pada skala Pauling
Tenaga pengionan
Pertama: 581.0 kJ/mol (ho+ gas)
Kedua: 1140 kJ/mol (ho2+ gas)
Ketiga: 2204 kJ/mol (ho3+ gas)
Kekonduksian terma
16.2 w/(m · k)
Resistiviti elektrik
814 nΩ · m
Nombor pengoksidaan
HOLM boleh dibentangkan dalam sebatiannya dengan nombor berikut atau pengoksidaan menyatakan: 0, +1 (ho+), +2 (ho2+) dan +3 (ho3+). Dari semuanya, +3 adalah yang paling biasa dan stabil. Oleh itu, Holm adalah logam trivalen, membentuk sebatian (ionik atau sebahagian ionik) di mana ia mengambil bahagian sebagai ion ho3+.
Boleh melayani anda: etil asetatSebagai contoh, dalam sebatian berikut, Holm dijumpai dengan nombor pengoksidaan +3: Ho2Sama ada3 (Ho23+Sama ada32-), Ho (oh)3, Hoi3 (Ho3+Yo3-) dan ho2(SW4)3.
Ho3+ Dan peralihan elektroniknya bertanggungjawab untuk sebatian logam ini kelihatan berwarna coklat. Walau bagaimanapun, apabila mereka memancarkan cahaya pendarfluor, mereka menjadi merah jambu. Perkara yang sama berlaku untuk penyelesaiannya.
Isotop
Holmio dibentangkan dalam alam semula jadi sebagai isotop stabil tunggal: 165Ho (kelimpahan 100%). Walau bagaimanapun, terdapat radioisotop buatan dengan separuh masa yang cukup banyak. Di antara mereka yang kita ada:
-163Ho (t1/2 = 4570 tahun)
-164Ho (t1/2 = 29 minit)
-166Ho (t1/2 = 26,763 jam)
-167Ho (t1/2 = 3.1 jam)
Pesanan dan momen magnet
Holm adalah logam paramagnetik, tetapi ia boleh menjadi ferromagnetik pada suhu 19 k, mempamerkan sifat magnet yang sangat kuat. Ia dicirikan dengan mempunyai momen magnet (10.6 μB) lebih besar di antara semua elemen kimia, serta kebolehtelapan magnet yang luar biasa.
Reaktiviti
Holm adalah logam yang dalam keadaan normal tidak terlalu cepat, jadi diperlukan untuk kehilangan kecerahannya. Walau bagaimanapun, apabila dia dipanaskan dengan lebih ringan, ia menjadi kekuningan, produk pembentukan lapisan oksida:
4 ho + 3 o2 → 2 Ho2Sama ada3
Bertindak balas dengan asid yang dicairkan atau pekat untuk menyebabkan garam masing -masing (nitrat, sulfat, dll.). Walau bagaimanapun dan menghairankan, ia tidak bertindak balas dengan asid fluorhoric, kerana lapisan HOF3 melindunginya dari kemerosotannya.
Holmio juga bertindak balas dengan semua halogen untuk menghasilkan halogenuros masing -masing (HOF3, Hocl3, Hob3 dan hoi3).
Struktur kimia
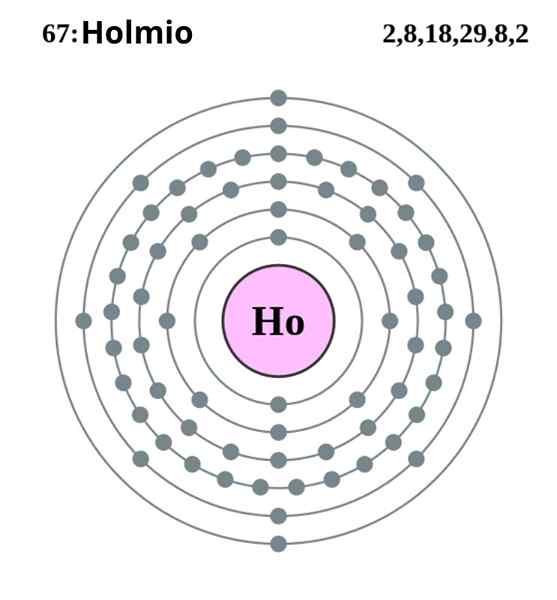 Konfigurasi Elektronik Holmio. Sumber: Pumba (Kerja Asal oleh Greg Robson) Creative Commons Pengiktirafan-Share Di bawah Lesen yang Sama 2.0 England dan Negara Wales
Konfigurasi Elektronik Holmio. Sumber: Pumba (Kerja Asal oleh Greg Robson) Creative Commons Pengiktirafan-Share Di bawah Lesen yang Sama 2.0 England dan Negara Wales Holmio mengkristal dalam struktur heksagon yang padat, HCP (untuk akronim dalam bahasa Inggeris: heksagon yang penuh sesak). Secara teorinya, atom Ho tetap bersatu padu dengan ikatan logam yang dibentuk oleh elektron orbital 4F mereka, menurut konfigurasi elektronik mereka:
Boleh melayani anda: pencairan: konsep, bagaimana ia dilakukan, contoh, latihan[Xe] 4fsebelas 6s2
Interaksi sedemikian, serta sistem tenaga elektronnya, menentukan sifat fizikal Holmio. Logam ini tidak diketahui apa -apa alotrope atau polimorf lain, bahkan tidak berada di bawah tekanan tinggi.
Aplikasi
Reaksi nuklear
Atom Holmio adalah penyerap neutron yang baik, jadi ia membantu mengawal perkembangan reaksi nuklear.
Spektroskopi
Penyelesaian Holmio Oxide digunakan untuk menentukur spektrofotometer, kerana spektrum penyerapan mereka hampir selalu kekal, tanpa mengira kekotoran yang terkandung. Ia juga menunjukkan jalur akut yang sangat ciri yang berkaitan dengan atom holmio, dan bukan pada sebatiannya.
Pewarna
Atom Holmio mampu menyediakan pewarnaan kemerahan ke kaca dan permata buatan circi lentur kubik.
Magnet
Pada suhu yang sangat rendah (30 K atau kurang), Holmius mempamerkan sifat magnet yang menarik, yang digunakan untuk mengeluarkan elektroma yang kuat, di mana ia membantu menumpukan medan magnet yang dihasilkan.
Bahan magnet sedemikian ditakdirkan untuk resonans magnetik nuklear; untuk pembangunan cakera keras, dengan kenangan yang berayun dalam urutan petabytes atau terabytes; dan mungkin mengeluarkan komputer kuantum.
Holmio Laser
Satu kristal garnet ititrio-aluminium (YAG) boleh doping dengan atom holmio untuk memancarkan radiasi yang panjang gelombangnya adalah 2 μm; Iaitu, kami mempunyai laser holm. Terima kasih kepadanya, tisu tumor dapat dipotong dengan tepat tanpa menyebabkan pendarahan, kerana tenaga yang dibekalkan dengan segera.
Laser ini telah digunakan secara berulang -ulang dalam pembedahan prostat dan pergigian, dan juga untuk menghapuskan sel -sel kanser dan batu ginjal.

