Interaksi hidrofobik Apa, kepentingan, contoh
- 4770
- 363
- Mr. Tracy Parisian
The Interaksi hidrofobik (HI) Mereka adalah daya yang mengekalkan perpaduan antara sebatian apolar yang direndam dalam larutan kutub atau pelarut. Tidak seperti interaksi bukan kovalen yang lain, seperti jambatan hidrogen, interaksi ionik atau daya van der Waals, interaksi hidrofobik tidak bergantung kepada sifat intrinsik larut, tetapi pada pelarut.
Contoh yang sangat ilustrasi interaksi ini boleh menjadi pemisahan fasa yang berlaku ketika datang untuk mencampurkan air dengan minyak. Dalam kes ini, molekul minyak "berinteraksi" antara satu sama lain sebagai hasil pesanan molekul air di sekelilingnya.
 Emulsi Lemak di Air (Catrin Sohrabi [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)], dari Wikimedia Commons)
Emulsi Lemak di Air (Catrin Sohrabi [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)], dari Wikimedia Commons) Pengertian interaksi ini wujud sejak sebelum empat puluhan. Walau bagaimanapun, istilah "pautan hidrofobik" dicipta oleh Kauzmann pada tahun 1959, sambil mengkaji faktor -faktor yang paling penting dalam penstabilan struktur tiga dimensi protein tertentu.
Beliau adalah interaksi tidak penting yang paling penting yang berlaku dalam sistem biologi. Mereka juga mempunyai peranan penting dalam pelbagai aplikasi kejuruteraan dan industri kimia dan farmaseutikal yang kita tahu hari ini.
Sebab interaksi hidrofobik
Penyebab fizikalnya adalah berdasarkan ketidakupayaan bahan apolar untuk membentuk ikatan hidrogen dengan molekul air dalam larutan.
Mereka dikenali sebagai "interaksi tidak spesifik" kerana mereka tidak berkaitan dengan pertalian antara molekul larut, tetapi dengan kecenderungan molekul air untuk mengekalkan interaksi mereka sendiri melalui ikatan hidrogen.
Boleh melayani anda: biosurfaktanApabila bersentuhan dengan air, molekul apolar atau hidrofobik cenderung menambah secara spontan, untuk mencapai kestabilan yang lebih besar dengan mengurangkan kawasan permukaan sentuhan dengan air.
Kesan ini boleh dikelirukan dengan tarikan yang kuat, tetapi tidak lebih daripada akibat dari sifat apolar bahan -bahan yang berkaitan dengan pelarut.
Diterangkan dari sudut pandangan termodinamik, persatuan spontan ini berlaku untuk mencari keadaan yang baik, di mana anda mempunyai variasi tenaga bebas yang paling rendah (ΔG).
Dengan mengambil kira bahawa ΔG = ΔH - TΔS, Keadaan yang paling bertenaga akan menjadi yang mana entropi (ΔS) Lebih besar, ia.
Apabila molekul apolar dikaitkan antara satu sama lain, dipaksa oleh molekul air, keadaan yang lebih baik diperoleh daripada jika molekul ini tetap dipisahkan, masing -masing dikelilingi oleh "sangkar" molekul air yang berbeza.
Kepentingan biologi
Dia mempunyai kaitan yang besar, kerana ia berlaku dalam kepelbagaian proses biokimia.
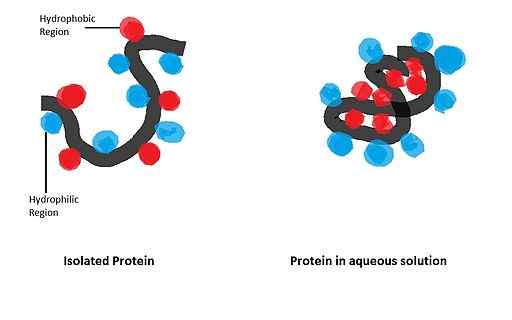
Antara proses ini ialah perubahan konformasi dalam protein, kesatuan substrat enzim, persatuan subunit kompleks enzimatik, pengagregatan dan pembentukan membran biologi, penstabilan protein dalam larutan akueus dan lain -lain.
Dalam istilah kuantitatif, penulis yang berbeza telah memberikan tugas menentukan kepentingannya dalam kestabilan struktur banyak protein, menyimpulkan bahawa interaksi ini menyumbang kepada lebih daripada 50 %.
Ia boleh melayani anda: glukosa oksidase: ciri, struktur, fungsiBanyak protein membran (integral dan persis. Di samping itu, kestabilan struktur tertiari banyak protein larut bergantung pada HI.
Beberapa teknik dalam kajian biologi sel mengeksploitasi harta yang beberapa detergen ionik POS.
Micels juga digunakan dalam kajian farmaseutikal yang melibatkan penyampaian ubat -ubatan yang larut lemak dan pembentukannya juga penting untuk penyerapan vitamin dan lipid kompleks dalam tubuh manusia.
Contoh interaksi hidrofobik
Membran
Contoh HI yang sangat baik ialah pembentukan membran sel. Struktur sedemikian terdiri daripada bilayer fosfolipid. Organisasi anda diberikan terima kasih kepada yang berlaku di antara ekor apolar dalam "penolakan" ke persekitaran berair di sekitarnya.
Protein
Dia mempunyai pengaruh yang besar terhadap lipatan protein globular, yang bentuknya aktif secara biologi diperolehi selepas penubuhan konfigurasi spatial tertentu, yang ditadbir oleh kehadiran sisa asid amino tertentu dalam struktur.
- Kes apomioglobin
Apomicoglobin (myoglobin kekurangan kumpulan hemo) adalah protein alpha-helicoidal kecil yang telah berfungsi sebagai model untuk mengkaji proses lipat dan kepentingannya di kalangan sisa apolar dalam rantaian polipeptida yang sama.
Dalam satu kajian yang dijalankan oleh Dyson dan kolaborator pada tahun 2006 di mana urutan mutasi apomioglobine digunakan, ditunjukkan bahawa permulaan peristiwa lipat ini bergantung pada asid amino dengan kumpulan apolar alpha.
Ia dapat melayani anda: hubungan antara materi dan tenaga yang diperhatikan dalam pemakanan selOleh itu, perubahan kecil yang diperkenalkan dalam urutan asid amino bermaksud pengubahsuaian penting dalam struktur tertiari, yang mengakibatkan protein yang tidak terbentuk dan tidak aktif.
Detergen
Satu lagi contoh yang jelas adalah cara tindakan detergen komersial yang kami gunakan untuk tujuan domestik setiap hari.
Detergen adalah molekul amphipatic (dengan rantau kutub dan apolar lain). Mereka boleh "mengemulsikan" lemak kerana mereka mempunyai keupayaan untuk membentuk ikatan hidrogen dengan molekul air dan mempunyai interaksi hidrofobik dengan lipid yang hadir dalam lemak.
Apabila bersentuhan dengan lemak ke dalam larutan berair, molekul detergen dikaitkan dengan satu sama lain dengan cara yang dihadapi ekor apolar, melampirkan molekul lipid, dan terdedah kepada permukaan mycela kawasan kutub, yang memasuki air.
Rujukan
- Chandler, d. (2005). Antara muka dan daya penggerak perhimpunan hidrofobik. Alam, 437(7059), 640-647.
- Dyson, J. H., Wright, ms. Dan., & Sheraga, h. Ke. (2006). Peranan interaksi hidrofobik dalam permulaan dan penyebaran lipatan protein. PNA, 103(35), 13057-13061.

