Undang -undang Gas Ideal Formula dan Unit, Aplikasi, Contoh

- 1439
- 171
- Clarence Greenholt DDS
The Undang -undang Gas Ideal Ia adalah persamaan negeri yang menggambarkan hubungan antara fungsi negara yang berkaitan dengan gas yang ideal; seperti suhu, tekanan, jumlah dan tahi lalat. Undang -undang ini membolehkan untuk mengkaji sistem gas sebenar yang membandingkannya dengan versi ideal mereka.
Gas yang ideal adalah gas teoritis, terdiri daripada zarah -zarah spesifik atau sfera yang bergerak secara rawak; Dengan tenaga kinetik yang hebat, di mana satu -satunya interaksi antara mereka adalah pertempuran elastik sepenuhnya. Di samping itu, mereka mematuhi undang -undang gas yang ideal.
 Undang -undang gas yang ideal membolehkan kajian dan pemahaman banyak sistem gas sebenar. Sumber: Pxhere.
Undang -undang gas yang ideal membolehkan kajian dan pemahaman banyak sistem gas sebenar. Sumber: Pxhere. Pada tekanan dan suhu standard (STP): 1 atm tekanan, dan suhu 0 ºC, kebanyakan gas sebenar berkelakuan kualitatif sebagai gas ideal; dengan syarat bahawa kepadatan mereka rendah. Jarak intermolecular atau interatomi yang besar (untuk gas mulia) memudahkan pendekatan tersebut.
Di bawah keadaan STP oksigen, nitrogen, hidrogen, gas mulia dan beberapa gas kompaun, seperti karbon dioksida, berkelakuan seperti gas ideal.
Model gas yang ideal cenderung gagal pada suhu rendah, tekanan tinggi, dan kepadatan partikel tinggi; Apabila interaksi intermolecular, serta saiz zarah, menjadi penting.
Undang-undang Gas Ideal adalah komposisi tiga undang-undang gas: Undang-undang Boyle dan Mariotte, Undang-undang Charles dan Gay-Lussac, dan Undang-undang Avogadro.
[TOC]
Formula dan unit

Undang -undang gas dinyatakan secara matematik dengan formula:
Pv = nrt
Di mana p adalah tekanan yang dikenakan oleh gas. Ia biasanya dinyatakan dengan unit atmosfera (ATM), walaupun ia boleh dinyatakan dalam unit lain: MMHG, Pascal, Bar, dll.
Volum V yang diduduki oleh gas biasanya dinyatakan dengan perpaduan liter (l). Manakala n Ia adalah bilangan tahi lalat, pemalar gas sejagat, dan suhu yang dinyatakan dalam kelvin (k).
Ekspresi yang paling banyak digunakan dalam gas r adalah bersamaan dengan 0.08206 l · atm · k-1· Mol-1. Walaupun unit pemalar gas mempunyai nilai 8,3145 j · mol-1· K-1. Kedua -duanya sah selagi mereka berhati -hati dengan unit pembolehubah lain (P, T dan V).
Undang-undang Gas Ideal adalah gabungan Undang-undang Boyle-Maleotte, Undang-undang Charles-Gay-Lussac dan Undang-undang Avogadro.
Undang-undang Boyle-Maleotte
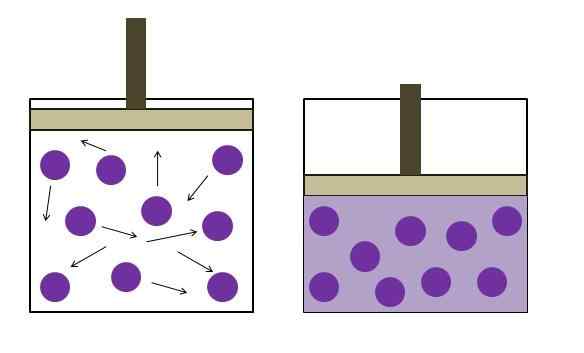 Peningkatan tekanan pengurangan tekanan. Sumber: Gabriel Bolívar
Peningkatan tekanan pengurangan tekanan. Sumber: Gabriel Bolívar Ia dirumuskan secara bebas oleh ahli fizik Robert Boyle (1662) dan fizikal dan botani Edme Mariotte (1676). Undang -undang dinyatakan seperti berikut: Pada suhu malar, jumlah jisim tetap gas berkadar songsang dengan tekanan yang ia lakukan.
Boleh melayani anda: terpenosPV ∝ K
Dengan menggunakan dua mata:
P1V1 = P2V2
Undang-undang Charles-Gay-Lussac
 Lentera Cina atau keinginan. Sumber: Pxhere.
Lentera Cina atau keinginan. Sumber: Pxhere. Undang-undang itu diterbitkan oleh Gay-Lussac pada tahun 1803, tetapi merujuk karya yang tidak diterbitkan oleh Jacques Charles (1787). Atas sebab ini undang -undang dikenali sebagai undang -undang Charles.
Undang -undang menetapkan bahawa pada tekanan berterusan, terdapat nisbah langsung berkadar antara jumlah yang diduduki oleh gas dan suhunya.
V ∝ k2T
Dengan menggunakan dua mata:
V1/T1 = V2/T2
V1T2 = V2T1
Undang -undang Avogadro
Undang -undang itu dinyatakan oleh Amadeo Avogadro pada tahun 1811, dengan menyatakan bahawa jumlah yang sama dari semua gas, pada tekanan dan suhu yang sama, mempunyai bilangan molekul yang sama.
V1/n1 = V2/n2
Apa yang Menetapkan Undang -undang Gas Ideal?
Melalui undang -undang gas yang ideal, hubungan antara empat sifat fizikal bebas gas ditubuhkan: tekanan, jumlah, suhu dan kuantiti gas. Sudah cukup untuk mengetahui nilai tiga daripadanya, untuk mendapatkan yang tinggal.
Undang -undang menetapkan syarat -syarat yang menunjukkan apabila gas berkelakuan ideal, dan apabila ia bergerak dari tingkah laku ini.
Contohnya, faktor mampatan yang dipanggil (PV/NRT) mempunyai nilai 1 untuk gas ideal. Nilai nilai 1 untuk faktor mampatan, menunjukkan bahawa tingkah laku gas bergerak dari gas ideal.
Oleh itu, kesilapan akan dibuat apabila menggunakan persamaan gas ideal kepada gas yang tidak berkelakuan mengikut model.
Aplikasi
Pengiraan ketumpatan dan jisim molar gas
Persamaan undang -undang gas ideal boleh digunakan dalam pengiraan ketumpatan gas dan jisim molarnya. Apabila membuat pengubahsuaian mudah, anda dapat mencari ungkapan matematik yang mengaitkan ketumpatan (d) gas dan jisim molarnya (M):
D = MP/RT
Dan membersihkan m:
M = drt/p
Pengiraan jumlah gas yang dihasilkan dalam tindak balas kimia
Stoikiometri adalah cabang kimia yang mengaitkan jumlah setiap reagen yang hadir dengan produk yang terlibat dalam tindak balas kimia, biasanya dinyatakan dalam tahi lalat.
Penggunaan persamaan gas ideal membolehkan penentuan jumlah gas yang dihasilkan dalam tindak balas kimia; Oleh kerana, dari reaksi kimia anda dapat memperoleh bilangan tahi lalat. Kemudian, jumlah gas boleh dikira:
Boleh melayani anda: ionomer kaca: penyediaan, sifat, jenis, kegunaanPv = nrt
V = NRT/P
Mengukur v dapat menentukan prestasi atau kemajuan reaksi tersebut. Apabila tidak ada lagi gas, menunjukkan bahawa reagen telah habis sepenuhnya.
Pengiraan tekanan separa gas yang terdapat dalam campuran
Undang -undang Gas Ideal boleh digunakan, bersama -sama dengan undang -undang tekanan separa Dalton, untuk mengira tekanan separa gas yang berlainan yang terdapat dalam campuran gas.
Hubungannya digunakan:
P = nrt/v
Untuk mencari tekanan setiap gas yang terdapat dalam campuran.
Jumlah gas yang dikumpulkan di dalam air
Tindak balas dibuat yang menghasilkan gas, yang dikumpulkan oleh reka bentuk eksperimen di dalam air. Tekanan gas total diketahui ditambah tekanan wap air. Nilai yang terakhir dapat diperolehi dalam jadual dan dengan pengurangan tekanan gas dapat dikira.
Dari stoikiometri tindak balas kimia, bilangan tahi lalat gas dapat diperoleh, dan menggunakan hubungan:
V = NRT/P
Jumlah gas yang dihasilkan dikira.
Contoh pengiraan
Latihan 1
Gas mempunyai ketumpatan 0.0847 g/L hingga 17 ºC, dan tekanan 760 Torr. Berapakah jisim molar anda? Apa itu Gas?
Kita mulakan dari persamaan
M = drt/p
Kami mula -mula menukar unit suhu ke Kelvin:
T = 17 ºC + 273.15 k = 290.15 k
Dan tekanan 760 Torr sepadan dengan 1 atm. Sekarang anda hanya perlu mengganti nilai dan menyelesaikannya:
M = (0.0847 g/l) (0.08206 l · atm · k-1· Mol-1) (290.15 k) / 1 atm
M = 2,016 g/mol
Jisim molar ini boleh sesuai dengan spesies tunggal: molekul hidrogen diatomik, h2.
Latihan 2
Jisim 0.00553 g merkuri (Hg) dalam fasa gas, berada dalam jumlah 520 L, dan pada suhu 507 k. Kirakan tekanan yang dikenakan oleh HG. Jisim molar Hg ialah 200.59 g/mol.
Masalahnya diselesaikan dengan menggunakan persamaan:
Pv = nrt
Maklumat mengenai bilangan tahi lalat HG tidak muncul; Tetapi mereka boleh didapati dengan menggunakan jisim molar mereka:
Moles of Hg = (0.00553 g Hg) (1 mol Hg/200.59 g)
Boleh melayani anda: oksigen: sifat, struktur, risiko, kegunaan= 2,757 · 10-5 Moles
Sekarang kita hanya perlu membersihkan p dan menggantikan nilai -nilai:
P = nrt/v
= (2,757 · 10-5 tahi lalat) (8,206 · 10-2 L · atm · k-1· Mol-1) (507 k)/ 520 l
= 2.2 · 10-6 Atm
Latihan 3
Kirakan tekanan yang dihasilkan oleh asid hidroklorik yang dihasilkan dengan bertindak balas 4.8 g gas klorin (CL2) dengan gas hidrogen (h2), Dalam jumlah 5.25 L, dan pada suhu 310 k. Jisim molar cl2 adalah 70.9 g/mol.
H2 g) + Cl2 g) → 2 HCl(g)
Masalahnya diselesaikan dengan menggunakan persamaan gas ideal. Tetapi jumlah HCl dinyatakan dalam gram dan bukan dalam tahi lalat, jadi transformasi yang dibuat dibuat.
Moles of Hcl = (4.8 g Cl2) (1 mol cl2/70.9 G Cl2) (2 mol HCl/1mol Cl2)
= 0.135 Moles HCl
Memohon persamaan Undang -undang Gas Ideal:
Pv = nrt
P = nrt/v
= (0.135 mol HCl) (0.08206 L · ATM · K-1· Mol-1) (310 k) / 5.25 l
= 0.65 atm
Latihan 4
Sampel 0.130 g sebatian gas menduduki jumlah 140 ml pada suhu 70 ºC dan pada tekanan 720 Torr. Berapakah jisim molar anda?
Untuk memohon persamaan gas yang ideal, beberapa perubahan mesti dibuat terlebih dahulu:
V = (140 ml) (1 l/1000 ml)
= 0.14 l
Mempunyai kelantangan dalam liter, kini anda perlu menyatakan suhu di Kelvin:
T = 70 ºC + 273.15 k = 243.15 k
Dan akhirnya, kita mesti mengubah tekanan ke dalam unit atmosfera:
P = (720 torr) (1 atm/760 torr)
= 0.947 atm
Langkah pertama dalam menyelesaikan masalah adalah untuk mendapatkan bilangan tahi lalat dari kompaun. Untuk ini, persamaan gas ideal digunakan dan kami dibersihkan n:
Pv = nrt
N = pv / rt
= (0.947 atm) (0.14 L) / (0.08206 l · atm · k-1· Mol-1) (243.15 k)
= 0.067 mol
Ia hanya perlu untuk mengira adunan molar dengan membahagikan gram antara tahi lalat yang diperoleh:
Jisim molar = gram kompaun / bilangan tahi lalat.
= 0.130 g / 0.067 tahi lalat
= 19.49 g/mol
Rujukan
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (8th ed.). Pembelajaran Cengage.
- Iran. Levine. (2014). Prinsip Fizikokimia. Edisi keenam. MC Graw Hill.
- Glasstone. (1970). Perjanjian Kimia Fizikal. Edisi kedua. Aguilar.
- Mathews, c. K., Van holde, k. Dan., Dan ahern, k. G. (2002). Biokimia. 3adalah Edisi. Editorial Pearson Addison Wesley.
- Wikipedia. (2019). Gas ideal. Diperoleh dari: dalam.Wikipedia.org
- Pasukan editorial. (2018). Boyle Law atau Boyle-Maleotte Law | Undang -undang gas. Pulih dari: iquimicas.com
- Jessie a. Kunci. (s.F.). Undang -undang gas dan sub aplikasi yang ideal. Diperolehi dari: OpenTextBC.Ac

