Lipasa Caracateristik, Struktur, Jenis, Fungsi
- 1980
- 436
- Dallas Bernhard
The Lipasas Mereka membentuk keluarga besar enzim yang mampu memangkinkan hidrolisis ikatan ester yang terdapat dalam substrat seperti trigliserida, fosfolipid, ester kolesterol dan beberapa vitamin.
Mereka hadir secara praktikal dalam semua kerajaan kehidupan, baik dalam mikroorganisma dan bakteria dan ragi, seperti dalam tumbuhan dan haiwan; Dalam setiap jenis organisma enzim ini mempunyai sifat dan ciri khas yang membezakannya antara satu sama lain.
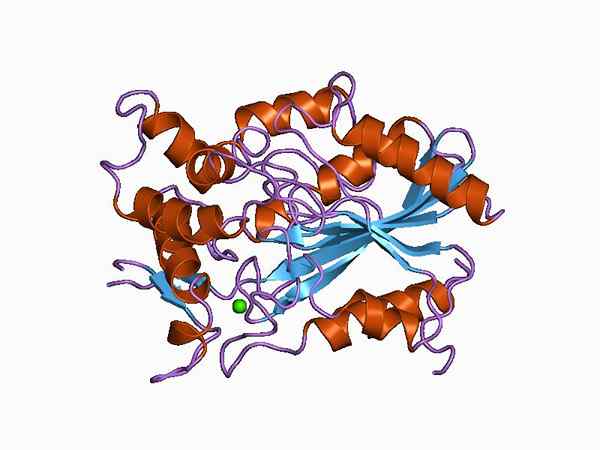
 Perwakilan grafik struktur molekul lipase (sumber: Jawahar Swaminathan dan kakitangan MSD di Institut Bioinformatik Eropah [Domain Awam] melalui Wikimedia Commons)
Perwakilan grafik struktur molekul lipase (sumber: Jawahar Swaminathan dan kakitangan MSD di Institut Bioinformatik Eropah [Domain Awam] melalui Wikimedia Commons) Bergantung pada jenis klasifikasi, perbezaan boleh dibuat antara lipasas "benar", yang juga dikenali sebagai Lipas triacylglycerol, dan enzim lain dengan aktiviti lipolitik yang sama seperti fosfolipase, esterol esteraeous dan tapak retinil-pealmitat.
Laporan pertama yang diterbitkan mengenai urutan enzim lipase ialah de Caro dan kolaborator pada tahun 1981, yang mempelajari triacilglycerol lipasa pankreas babi. Kajian berikutnya menunjukkan kewujudan banyak lipase sistemik lain dalam organisma hidup.
Lipase yang paling penting dalam haiwan adalah lipase pencernaan yang dihasilkan oleh pankreas dan hati, yang mengambil bahagian dalam metabolisme lemak yang digunakan dalam diet secara teratur, dan oleh itu mempunyai implikasi fisiologi yang penting dari pelbagai sudut pandangan.
Pada masa ini, enzim ini bukan sahaja dikaji untuk tujuan klinikal dan/atau metabolik, tetapi juga menghasilkan industri untuk tujuan komersil untuk pemprosesan makanan dan produk lain, dan boleh diperolehi daripada penanaman mikroorganisma khas.
[TOC]
Ciri -ciri
Lipasas adalah protein larut air dan memangkinkan tindak balas hidrolisis dalam substrat yang tidak larut. Mereka didapati dalam keseimbangan antara bentuk aktif mereka dan bentuk dan pengaktifan yang tidak aktif atau inaktivasi bergantung kepada faktor dalaman yang berbeza.
Boleh melayani anda: Glucans: Struktur, Ciri dan FungsiMereka tergolong dalam enzim hidrolysase superfamily dengan lipatan α/β, di mana tikar, thioestie, beberapa protease dan peroksidase, defalus dan hidrolase intrasel lain juga diklasifikasikan.
Lipase dikodkan oleh gen yang tergolong dalam keluarga yang merangkumi gen pengekodan lipase pankreas, lipase hepatik, lipase lipoproteik, lipase endothelial dan phosphatidylserine phospholipase A1.
Mekanisme pemangkin
Beberapa penulis mencadangkan bahawa bentuk pemangkinan bahawa enzim -enzim ini sama dengan protease, yang berkaitan dengan kehadiran tiga sisa asid amino khas di tapak aktif.
Mekanisme hidrolisis membayangkan pembentukan kompleks enzim-substrat (lipase: trigliserida), seterusnya pembentukan perantara hemiacetal dan kemudian pembebasan diacylglyceride dan asid lemak.
Langkah terakhir hidrolisis, pelepasan asid lemak dari tapak aktif, berlaku oleh model yang dikenali sebagai model "catapult", yang menunjukkan bahawa selepas clivaje atau pecah ikatan ester, asid lemak dikeluarkan dengan cepat dari laman web tersebut pemangkin.
Kekhususan substrat
Lipase boleh menjadi spesifik dan membezakan antara substrat seperti trigliserida, diacylglycerides, monogliserida dan fosfolipid. Ada yang khusus dalam asid lemak, iaitu, berkenaan dengan panjangnya, tahap ketepuan mereka, dll.
Mereka juga boleh selektif dari segi rantau di mana hidrolisis memangkinkan, ini bermakna bahawa mereka boleh mempunyai kekhususan kedudukan berkenaan dengan tapak yang mana molekul asid lemak disertai ke rangka gliserol (di mana -mana tiga karbon).
Struktur
Serta ahli keluarga enzimatik yang lain, lipase dicirikan oleh topologi yang terdiri daripada lembaran bersalut α dan β. Tapak pemangkin enzim ini biasanya terdiri daripada triad asid amino: asid serine, aspartik atau glutamat dan histidin.
Boleh melayani anda: autopoiesisKebanyakan lipase adalah glikoprotein yang, bergantung kepada saiz bahagian karbohidrat, mempunyai antara 50 dan 70 kDa berat molekul.
Lipase pankreas manusia
Ia mempunyai 449 sisa asid amino dan dua domain berasingan: satu terminal N, di mana tapak pemangkin dan lipatan ciri hidrolase (α/β), dan satu lagi terminal C, lebih kecil dan lebih kecil dan dianggap "tambahan", dengan struktur dipanggil "sandwic β".
Berat molekulnya adalah antara 45 dan 53 kDa dan aktiviti pemangkinnya lebih tinggi pada suhu hampir 37 ° C dan pH antara 6 dan 10 dan 10.
Fungsi
Bergantung pada organ di mana mereka berada dalam mamalia, contohnya, lipase menjalankan fungsi fisiologi yang agak berbeza.
Seperti yang disebutkan, terdapat lipasas tertentu di pankreas, hati, ovari dan kelenjar adrenal (di buah pinggang) dan dalam tisu endothelial.
Lipase hepatik bertanggungjawab terhadap metabolisme zarah lipoproteik, yang kompleks dibentuk oleh lipid dan protein yang berfungsi terutamanya dalam pengangkutan trigliserida dan kolesterol antara organ dan tisu.
Khususnya, lipase mengambil bahagian dalam hidrolisis atau pembebasan asid lemak dari molekul trigliserida yang terkandung dalam lipoprotein. Ini adalah perlu untuk mengekstrak tenaga dari molekul ini atau mengitar semula mereka, menggunakannya sebagai prekursor dalam sintesis sebatian lain.
Lipase endothelial terdapat di hati, paru -paru, tiroid dan organ pembiakan dan ekspresi gen mereka dikawal oleh sitokin yang berbeza. Enzim -enzim ini juga mengambil bahagian dalam metabolisme lipoprotein.
Fungsi perindustrian
Dalam industri pengeluaran makanan tenusu, penggunaan lipase adalah biasa untuk menghidrolisiskan lemak yang ada dalam susu, yang mempunyai kesan langsung ke atas "potentiasi" rasa dalam keju, krim dan produk tenusu lain.
Boleh melayani anda: Glyceraldehyde 3-fosfat (G3P): Struktur, FungsiMereka juga digunakan dalam pembuatan produk makanan lain, terutama semasa penapaian, untuk meningkatkan rasa dan "kemusnahan" beberapa makanan penyediaan makanan.
Jauh dari industri makanan, penggunaan lipase asal mikrob adalah popular dalam perumusan pencuci dan bahan pembersihan umum, yang mengurangkan kesan buruk terhadap persekitaran yang melibatkan beban kimia yang besar yang ada dalam produk pembersihan konvensional.
Rujukan
- Lowe, m. Dan. (2002). Lipase trigliserida pankreas. Jurnal Penyelidikan Lipid, 43, 2007-2016.
- Mead, j. R., Irvine, s. Ke., & Ramji, D. P. (2002). Lipase lipase: struktur, fungsi, peraturan, dan peranan dalam penyakit. J. Mol. Med., 80, 753-769.
- Perret, b., Mabile, l., Martinez, l., Ketiga, f., Barbaras, r., & Collet, x. (2002). Lipase Hepatik: Hubungan Struktur / Fungsi, Sintesis, dan Peraturan. Jurnal Penyelidikan Lipid, 43, 1163-1169.
- Santamarina-Fojo, s., González-Navarro, h., Freeman, l., Wagner, e., Santamarina-Fojo, s., Gonza, h.,... nong, z. (2004). Lipase hepatik, metabolisme lipoprotein, dan atherogenesis. Arteriosklerosis, trombosis, dan biologi vaskular, 24, 1750-1754.
- Taylor, ms., Kurtovic, i., Marshall, s. N., Zhao, x., Simpson, b. K., Kurtovic, i.,... Zhao, x. Yo. N. (2012). Lipase dari mamalia dan ikan. Ulasan dalam Sains Perikanan, 29, 37-41.
- « Definisi, syarat, latihan vektor bukan vektor
- Definisi vektor yang melengkapkan, notasi, latihan »

