Myoglobin

- 4143
- 203
- Kerry Schmitt
 Struktur Myoglobin
Struktur Myoglobin Apa itu myoglobin?
The Myoglobin Ia adalah protein globular intraselular yang terdapat di sitosol sel otot rangka dan jantung. Fungsi asasnya adalah untuk membentuk rizab oksigen dan memihak pengangkutan oksigen intraselular.
John Kendrew dan Max Perutz menerima Hadiah Nobel dalam Kimia pada tahun 1962 untuk kajian mereka mengenai protein globular. Penulis ini menjelaskan struktur tiga dimensi myoglobin dan hemoglobin, masing -masing. Sejarah Myoglobin adalah salah satu protein pertama yang mana struktur tiga dimensi ditentukan.
Protein globular adalah molekul padat dengan bentuk sfera; Mereka larut dalam sitosol atau di bahagian lipid membran sel. Mereka bertanggungjawab untuk tindakan biologi utama, berbanding dengan protein berserabut, yang fungsi utamanya adalah struktur.
Myoglobin memberikan daging segar merah. Ini berlaku apabila myoglobin oksigen sebagai oximioglobin dan besi yang membentuknya dalam besi ferrous: mb-fe2+o2.
Apabila daging terdedah kepada alam sekitar, ferus, tidak stabil, teroksida dan menjadi ferrik dan di bawah syarat-syarat ini perubahan warna kepada nada coklat untuk pembentukan metamioglobin (MB-Fe3 + + O2 ●-).
Biasanya tahap myglobin darah sangat kecil, mereka berada dalam urutan mikrogram seliter (μg/l). Tahap ini meningkat apabila kemusnahan otot berlaku seperti dalam rhabdomyolysis otot rangka atau dalam kes infarksi jantung dengan kemusnahan tisu dan dalam beberapa myopathies.
Kehadirannya dalam air kencing diperhatikan dalam keadaan tertentu di mana kerosakan tisu sangat penting. Nilai diagnostik awal untuk infark jantung boleh dibahaskan.
Boleh melayani anda: teras selStruktur Myoglobin
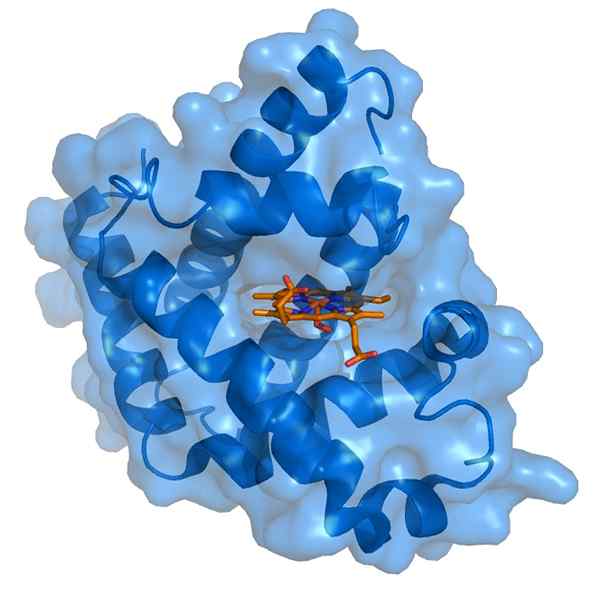 Myoglobin dan kumpulan prostetik hemo (sumber: Thomas spletttsser/cc by-s (https: // creativecommons.Org/lesen/by-sa/3.0) melalui Wikimedia Commons)
Myoglobin dan kumpulan prostetik hemo (sumber: Thomas spletttsser/cc by-s (https: // creativecommons.Org/lesen/by-sa/3.0) melalui Wikimedia Commons) Myoglobin mempunyai berat molekul hampir 18 kDa termasuk kumpulan hemo. Ia terdiri daripada empat segmen heliks yang disatukan oleh "giliran tiba -tiba". Kipas myoglobin ini dibungkus dengan teliti dan mengekalkan integriti struktur mereka walaupun kumpulan hemo dikeluarkan.
Struktur protein globular, serta semua protein sel, adalah hierarki, jadi struktur myoglobin juga. Tahap pertama adalah struktur utama yang dibentuk oleh urutan linear asid amino dan myoglobin terdiri daripada rantai asid amino 153.
Struktur sekunder myoglobin terdiri daripada pembentukan alpha kipas. Myoglobin mengandungi 8 kipas alpha yang dibentuk oleh bahagian polipeptida berulang yang mengikat oleh segmen pengurusan aperiad yang pendek.
Struktur Tertiary terdiri daripada penyesuaian tiga dimensi dengan aktiviti biologi. Ciri -ciri yang paling penting dalam struktur ini adalah lipat. Struktur Quaternary merujuk kepada perhimpunan dua atau lebih rantai polipeptida yang berasingan dan bersatu melalui pautan atau interaksi yang tidak bersatu padu.
Myoglobin mempunyai struktur yang sangat padat, dengan sisa hidrofobik yang diarahkan ke arah sisa dalaman dan hidrofilik atau kutub yang diarahkan ke luar. Sisa apolar dalaman dibentuk oleh leucine, valine, metodin dan phenylalanine. Satu -satunya sisa kutub dalaman adalah dua histidin yang mempunyai fungsi di pusat aktif.
Kumpulan prostetik hemo terletak di bahagian dalam bahagian dalaman apolar dari rantai polyloglobin polypeptide. Kumpulan ini mengandungi besi dalam bentuk besi ferus, yang mengikat oksigen untuk membentuk oximioglobin.
Boleh melayani anda: GLUT4: ciri, struktur, fungsiFungsi myoglobin
Fungsi myoglobin adalah untuk menyatukan oksigen ke kumpulan hemo strukturnya dan membentuk rizab oksigen untuk fungsi otot. Sejauh mana oksigen terperangkap dalam struktur myoglobin dalam sitoplasma sel otot, tekanan intraselularnya, yang ditentukan oleh oksigen bebas, kekal rendah.
Tekanan oksigen intrasel yang rendah mengekalkan kecerunan untuk masuk oksigen ke sel. Ini memihak kepada laluan oksigen dari torrent peredaran ke sel otot. Apabila myoglobin menembusi oksigen intraselular meningkat, yang secara progresif mengurangkan kecerunan dan dengan itu mengurangkan pemindahan.
Keluk mengikat oksigen ke myoglobin adalah hiperbola. Di bahagian awal lengkung, perubahan kecil dalam tekanan oksigen separa menghasilkan perubahan besar dalam tepu myoglobin dengan oksigen.
Kemudian, setakat bahawa tekanan oksigen separa meningkatkan ketepuan terus meningkat, tetapi lebih perlahan, iaitu peningkatan yang lebih besar dalam tekanan oksigen separa diperlukan untuk meningkatkan ketepuan myoglobin, dan progresif lengkungnya meratakan.
Terdapat pemboleh ubah yang mengukur pertalian lengkung yang dipanggil p50, ini mewakili tekanan separa oksigen yang diperlukan untuk menenun myoglobin yang terkandung dalam larutan sebanyak 50%. Oleh itu, jika P50 meningkat, dikatakan bahawa myoglobin mempunyai pertalian yang kurang dan jika P50 berkurangan, dikatakan bahawa myoglobin mempunyai pertalian yang lebih besar untuk oksigen.
Boleh melayani anda: proeritroblast: ciri, morfologi, peraturan, pewarnaanApabila lengkung mengikat oksigen dengan myoglobin dan hemoglobin diperiksa, diperhatikan bahawa untuk sebarang tekanan oksigen separa, myoglobin adalah tepu dan bukannya hemoglobin, menunjukkan bahawa myoglobin mempunyai pertalian yang lebih besar untuk oksigen daripada oksigen daripada hemoglobin.
Jenis serat otot dan myoglobin
Otot rangka mempunyai pelbagai jenis gentian otot dalam komposisi mereka, beberapa panggilan kontraksi yang perlahan dan lain -lain penguncupan pesat. Serat penguncupan pantas secara struktural dan metabolik disesuaikan dengan kontrak dengan cepat dan bersungguh -sungguh dan dengan cara anaerobik.
Serat penguncupan perlahan disesuaikan untuk kelajuan rendah, tetapi lebih banyak kontraksi yang berpanjangan, tipikal latihan rintangan aerobik. Salah satu perbezaan struktur gentian ini ialah kepekatan myoglobin, yang memberi mereka nama serat putih dan merah.
Serat merah mempunyai kandungan myoglobin yang tinggi, yang memberi mereka warna merah, tetapi juga membolehkan mereka mengekalkan sejumlah besar oksigen, yang sangat diperlukan untuk fungsi mereka.
Nilai normal
Nilai darah normal untuk lelaki dari 19 hingga 92 μg/L dan pada wanita dari 12 hingga 76 μg/l, bagaimanapun, terdapat perbezaan nilai di makmal yang berbeza.
Nilai -nilai ini meningkat apabila kemusnahan otot berlaku seperti dalam rhabdomyolysis otot rangka, dalam luka bakar yang luas, kejutan elektrik atau dalam nekrosis otot yang luas disebabkan oleh oklusi arteri, dalam infark miokard dan dalam beberapa miopati.
Di bawah syarat -syarat ini myoglobin muncul dalam air kencing dan memberikannya warna ciri.

