Model atom Schrödinger
- 1559
- 118
- Horace Gulgowski
Apakah model atom Schrödinger?
Dia Model atom Schrödinger Ini adalah cadangan untuk operasi dan struktur atom yang dibangunkan oleh Erwin Schrödinger pada tahun 1926. Ia dikenali sebagai model mekanikal kuantum atom, dan menggambarkan tingkah laku gelombang elektron.
Untuk ini, ahli fizik Austria yang luar biasa didasarkan pada hipotesis Broglie, yang menyatakan bahawa setiap zarah bergerak dikaitkan dengan gelombang dan boleh berkelakuan seperti itu.
 Erwin Schrödinger
Erwin Schrödinger Schrödinger mencadangkan bahawa pergerakan elektron dalam atom sesuai dengan dualitas gelombang-zarah, dan akibatnya, elektron dapat menggerakkan sekitar nukleus sebagai gelombang pegun.
Schrödinger, yang dianugerahkan Hadiah Nobel pada tahun 1933 atas sumbangannya kepada teori atom, mengembangkan persamaan homonim untuk mengira kebarangkalian bahawa elektron akan berada dalam kedudukan tertentu.
Ciri -ciri Model Atom Schrödinger
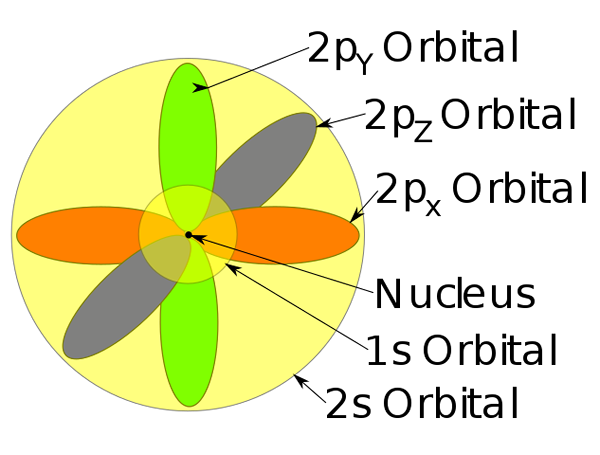 Orbitals 1s, 2s dan 2p di dalam atom natrium.
Orbitals 1s, 2s dan 2p di dalam atom natrium. -Model atom ini menerangkan pergerakan elektron sebagai gelombang pegun.
-Elektron bergerak sentiasa, iaitu, mereka tidak mempunyai kedudukan tetap atau ditakrifkan dalam atom.
-Model ini tidak meramalkan lokasi elektron, dan tidak menggambarkan laluan yang dibuat dalam atom. Hanya menetapkan zon kebarangkalian untuk mencari elektron.
-Kawasan kebarangkalian ini dipanggil orbital atom. Orbital menggambarkan pergerakan terjemahan di sekitar nukleus atom.
-Orbital atom ini mempunyai tahap yang berbeza dan sub -level tenaga, dan boleh ditakrifkan di antara awan elektron.
-Model ini tidak merenungkan kestabilan nukleus, ia hanya merujuk untuk menerangkan mekanik kuantum yang berkaitan dengan pergerakan elektron dalam atom.
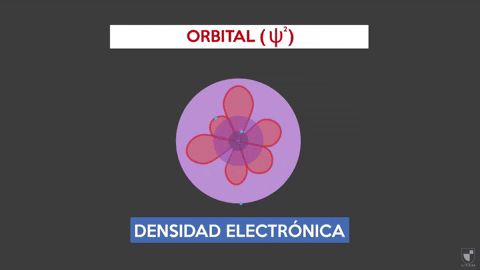 Ketumpatan elektronik menunjukkan kebarangkalian mencari elektron berhampiran nukleus. Lebih dekat nukleus (zon ungu) akan ada kebarangkalian lebih banyak, sementara itu akan kurang jika anda berpindah dari nukleus (kawasan violet).
Ketumpatan elektronik menunjukkan kebarangkalian mencari elektron berhampiran nukleus. Lebih dekat nukleus (zon ungu) akan ada kebarangkalian lebih banyak, sementara itu akan kurang jika anda berpindah dari nukleus (kawasan violet). Eksperimen
Model atom Schrödinger didasarkan pada hipotesis Broglie, serta model atom sebelumnya Bohr dan Sommerfeld.
Boleh melayani anda: geseran dinamik atau kinetik: pekali, contoh, latihanBroglie mencadangkan bahawa sama seperti gelombang mempunyai zarah, zarah mempunyai sifat gelombang, mempunyai panjang gelombang yang berkaitan. Sesuatu yang menjana banyak jangkaan pada masa itu, menjadi Albert Einstein sendiri pada teorinya.
Walau bagaimanapun, teori Broglie mempunyai kekurangan, iaitu makna idea sendiri tidak difahami dengan baik: elektron boleh menjadi gelombang, tetapi bagaimana dengan apa? Itulah ketika sosok Schrödinger nampaknya menjawab.
Untuk melakukan ini, ahli fizik Austria bergantung pada percubaan Young, dan berdasarkan pemerhatiannya sendiri, dia mengembangkan ungkapan matematik yang menanggung namanya.
Seterusnya asas saintifik model atom ini:
Eksperimen Young: Demonstrasi Pertama Duality Gelombang-Gelombang
Hipotesis Broglie mengenai sifat bergelora dan korpuskular subjek dapat ditunjukkan oleh eksperimen Young, juga dikenali sebagai percubaan celah ganda.
Saintis Inggeris Thomas Young meletakkan asas -asas model atom Schrödinger ketika pada tahun 1801 dia menjalankan eksperimen untuk mengesahkan sifat cahaya yang beralun.
Semasa percubaannya, Young membahagikan pelepasan rasuk cahaya yang melintasi lubang kecil melalui ruang pemerhatian. Bahagian ini dicapai dengan menggunakan kad 0.2 milimeter, yang terletak selari dengan rasuk.
Reka bentuk eksperimen dibuat untuk rasuk cahaya menjadi lebih luas daripada kad, dengan itu meletakkan kad secara mendatar, rasuk dibahagikan kepada kira -kira bahagian yang sama. Keluar dari rasuk cahaya diarahkan oleh cermin.
Boleh melayani anda: Jarak JarakKedua -dua rasuk cahaya memukul dinding di bilik gelap. Di sana corak gangguan antara kedua -dua gelombang itu dibuktikan, yang ditunjukkan bahawa cahaya dapat berkelakuan sebanyak zarah dan gelombang.

Satu abad kemudian, Albert Einsten memperkuat idea melalui prinsip -prinsip mekanik kuantum.
Persamaan Schrödinger
Schrödinger mengembangkan dua model matematik, membezakan apa yang berlaku bergantung kepada sama ada keadaan kuantum berubah dari masa ke masa atau tidak.
Untuk analisis atom, Schrödinger diterbitkan pada akhir 1926.
Ini menunjukkan bahawa gelombang tidak bergerak, nodnya, iaitu, titik keseimbangannya, berfungsi sebagai pivot untuk seluruh struktur untuk bergerak di sekelilingnya, menggambarkan kekerapan dan amplitud tertentu.
Schrödinger menentukan gelombang yang menggambarkan elektron sebagai keadaan pegun atau orbit, dan dikaitkan, pada gilirannya, pada tahap tenaga yang berbeza.
Persamaan masa bebas Schrödinger adalah seperti berikut:
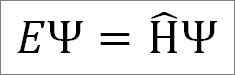
Di mana:
Dan: Pemalar proporsional.
Ψ: Fungsi gelombang sistem kuantum.
Η ̂: Pengendali Hamiltonian.
Persamaan masa bebas Schrödinger digunakan apabila diperhatikan yang mewakili jumlah tenaga sistem, yang dikenali sebagai pengendali Hamiltonian, tidak bergantung pada masa. Walau bagaimanapun, fungsi yang menggambarkan pergerakan gelombang total akan sentiasa bergantung pada masa.
Persamaan Schrödinger menunjukkan bahawa jika anda mempunyai fungsi gelombang ψ, dan pengendali Hamiltonian bertindak ke atasnya, pemalar perkadaran dan mewakili jumlah tenaga sistem kuantum di salah satu keadaan pegunnya.
Ia boleh melayani anda: Pembolehubah Diskret: Ciri dan ContohDigunakan untuk model atom Schrödinger, jika elektron bergerak di ruang yang ditetapkan, terdapat nilai tenaga diskret, dan jika elektron bebas beralih ke ruang angkasa, selang tenaga berterusan ada.
Dari sudut pandangan matematik, terdapat beberapa penyelesaian untuk persamaan Schrödinger, setiap penyelesaian menunjukkan nilai yang berbeza untuk pemalar berkadar dan.
Menurut prinsip ketidakpastian Heisenberg, tidak mungkin untuk menganggarkan kedudukan atau tenaga elektron. Oleh itu, saintis mengakui bahawa anggaran lokasi elektron dalam atom tidak tepat.
Postulates model atom Schrödinger
Postulates model atom Schrödinger adalah seperti berikut:
-Elektron berkelakuan sebagai gelombang pegun yang diedarkan di angkasa mengikut fungsi gelombang ψ.
-Elektron bergerak di dalam atom yang menggambarkan orbital. Ini adalah kawasan di mana kebarangkalian mencari elektron jauh lebih tinggi. Kebarangkalian yang disebutkan di atas adalah berkadar dengan kuadrat fungsi gelombang ψ2.
Konfigurasi elektronik model atom Schrödinguer menerangkan sifat berkala atom dan pautan yang membentuk.
Walau bagaimanapun, model atom Schrödinger tidak merenungkan spin elektron, dan tidak menganggap variasi elektron cepat disebabkan oleh kesan relativistik akibat kesan relativistik.
Artikel yang menarik
Model Broglie Atom.
Model Atom Chadwick.
Model Atom Heisenberg.
Model atom Perrin.
Model Thomson Atom.
Model Atom Dalton.
Model Atom Dirac Jordan.
Model Atom Democritus.
Model Atom Leucipo.
Model Atom Bohr.
Model atom Sommerfeld.
Model atom semasa.
Rujukan
- Model mekanikal kuantum atom yang pulih dari: ia adalah.Khanacademy.org
- Persamaan Gelombang Schrödinger (s.F.). Jaime I University. Castellón, Sepanyol. Pulih dari: Uji.adalah
- Teori Atom Moden: Model. © Abcte. Pulih dari: abcte.org
- Mod atom Schrodinger.F.). Pulih dari: Erwinschrodingerbiography.Weebly.com
- Wikipedia, ensiklopedia percuma. Persamaan Schrödinger. Pulih dari: Adakah.Wikipedia.org
- Wikipedia, ensiklopedia percuma. Eksperimen muda. Pulih dari: Adakah.Wikipedia.org

