Ciri -ciri Model Atom Sommerfeld, Postulates, Kelebihan dan Kekurangan
- 3947
- 453
- Clarence Greenholt DDS
Dia Model atom Sommerfeld Ia dicipta oleh ahli fizik Jerman Arnold Sommerfeld antara tahun 1915 dan 1916, untuk menjelaskan fakta -fakta bahawa model Bohr, yang dikeluarkan tidak lama sebelum tahun 1913, tidak dapat menjelaskan dengan memuaskan. Sommerfeld membentangkan hasilnya terlebih dahulu kepada Bavaria Academy of Sciences dan kemudian menerbitkannya di Majalah Annalen der Physik.
Model atom yang dicadangkan oleh ahli fizik Denmark Niels Bohr menerangkan.
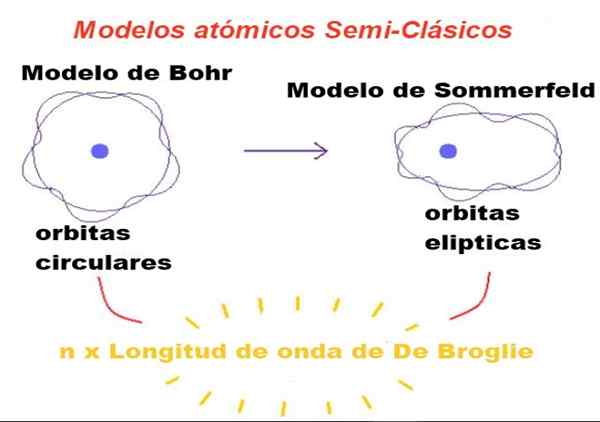
 Rajah 1. Dalam model separa klasik, orbit adalah Newtonian, tetapi hanya mereka yang perimeternya adalah bilangan integer kali panjang gelombang broglie dibenarkan. Sumber: f. Zapata.
Rajah 1. Dalam model separa klasik, orbit adalah Newtonian, tetapi hanya mereka yang perimeternya adalah bilangan integer kali panjang gelombang broglie dibenarkan. Sumber: f. Zapata. Dalam teori yang dicadangkan oleh Bohr, elektron yang mengorbit di sekitar nukleus hanya boleh mempunyai nilai -nilai tertentu dari momen sudut orbitalnya, dan oleh itu ia tidak boleh berada di mana -mana orbit.
Bohr juga menganggap bahawa orbit ini adalah bulat dan nombor kuantum tunggal yang dipanggil nombor kuantum utama n = 1, 2, 3 ... berkhidmat untuk mengenal pasti orbit yang dibenarkan.
Pengubahsuaian pertama yang diperkenalkan oleh Sommerfeld kepada model Bohr terdiri daripada mengandaikan bahawa orbit elektron juga boleh elips.
Lingkaran diterangkan oleh jejari, tetapi untuk elips anda perlu memberi dua parameter: separuh -senije dan separuh kecil, sebagai tambahan kepada orientasi spatial yang sama. Dengan ini dia memperkenalkan dua nombor kuantum.
Pengubahsuaian utama kedua yang dibuat Sommerfeld adalah untuk menambah kesan relativistik kepada model atom. Tidak ada yang lebih cepat daripada cahaya, namun Sommerfeld telah menemui elektron dengan kelajuan yang sangat dekat, oleh itu perlu menggabungkan kesan relativistik dalam sebarang penerangan atom.
[TOC]
Postulates model atom Sommerfeld
Elektron mengikuti orbit bulat dan elips
Elektron di atom mengikuti orbit elips (orbit bulat adalah kes tertentu) dan status tenaga mereka boleh dicirikan oleh 3 nombor kuantum: nombor kuantum utama n, Nombor kuantum sekunder atau nombor azimutal L dan nombor kuantum magnet mL.
Boleh melayani anda: garam binariTidak seperti lilitan, elips mempunyai separuh yang lebih besar dan separuh kecil.
Tetapi elips dengan separuh -axis utama yang sama, mereka boleh mempunyai separuh kecil yang berlainan, bergantung kepada tahap eksentrik. Eksentrik sama dengan 0 sepadan dengan bulatan, jadi ia tidak menolak trajektori bulat. Di samping itu, dalam elips ruang boleh mempunyai kecenderungan yang berbeza.
Itulah sebabnya Sommerfeld menambah modelnya nombor kuantum sekunder L untuk menunjukkan separuh kecil dan nombor kuantum magnet mL. Oleh itu, beliau menegaskan apakah orientasi spatial yang dibenarkan dari orbit elips.
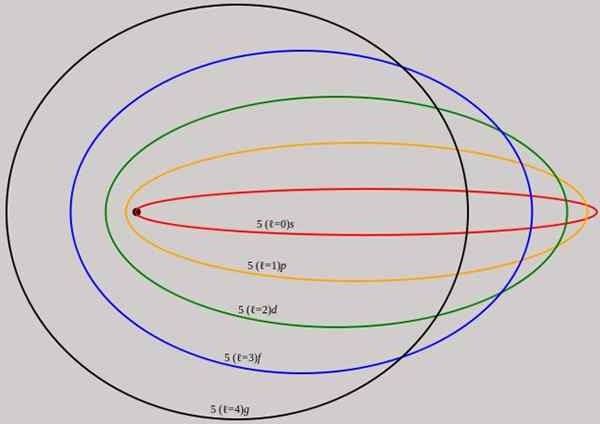 Rajah 2. Orbit yang sepadan dengan tahap tenaga n = 5 ditunjukkan untuk momentum sudut yang berbeza l yang mempunyai panjang gelombang lengkap de broglie. Sumber: Wikimedia Commons.
Rajah 2. Orbit yang sepadan dengan tahap tenaga n = 5 ditunjukkan untuk momentum sudut yang berbeza l yang mempunyai panjang gelombang lengkap de broglie. Sumber: Wikimedia Commons. Perhatikan bahawa ia tidak menambah nombor kuantum utama baru, jadi jumlah tenaga elektron dalam orbit elips adalah sama seperti dalam model Bohr. Oleh itu tidak ada tahap tenaga baru, tetapi pembukaan tahap yang diberikan oleh nombor n.
Kesan zeeman dan kesan nyata
Dengan cara ini adalah mungkin untuk menentukan sepenuhnya orbit yang diberikan, terima kasih kepada 3 nombor kuantum yang disebutkan dan dengan itu menjelaskan kewujudan dua kesan: kesan zeeman dan kesan stark.
Dan sebagainya menerangkan tenaga yang berlaku dalam kesan zeeman biasa (terdapat juga kesan zeeman anomali), di mana garis spektrum dibahagikan kepada beberapa komponen apabila ia berada di hadapan medan magnet.
Ini yang berlaku dari garis -garis ini juga berlaku dengan kehadiran medan elektrik, yang dikenali sebagai kesan Stark, yang menyebabkan Sommerfeld memikirkan pengubahsuaian model Bohr untuk menjelaskan kesan -kesan ini.
Nukleus dan elektron atom bergerak di sekitar pusat jisimnya
Selepas Ernest Rutherford menemui nukleus atom dan hakikat bahawa hampir seluruh jisim atom tertumpu di sana, para saintis percaya bahawa nukleus lebih kurang.
Ia boleh melayani anda: lithium hidroksida (lioh)Walau bagaimanapun, Sommerfeld mengumumkan bahawa kedua -dua nukleus dan elektron di orbit bergerak di sekitar pusat massa sistem, yang tentunya sangat dekat dengan nukleus. Modelnya menggunakan jisim yang dikurangkan dari sistem nukleus elektron, bukannya jisim elektron.
Di orbit elips, seperti planet -planet di sekitar matahari, ada kalanya elektron lebih dekat, dan di lain -lain lebih jauh dari nukleus. Oleh itu kelajuannya berbeza di setiap titik orbitnya.
 Rajah 3.- Arnold Sommerfeld. Sumber: Wikimedia Commons. Gfhund [cc oleh 3.0 (https: // creativeCommons.Org/lesen/oleh/3.0)].
Rajah 3.- Arnold Sommerfeld. Sumber: Wikimedia Commons. Gfhund [cc oleh 3.0 (https: // creativeCommons.Org/lesen/oleh/3.0)]. Elektron dapat mencapai kelajuan relativistik
Sommerfeld diperkenalkan ke dalam modelnya pemalar struktur halus, malar tanpa dimensi yang berkaitan dengan daya elektromagnet:
α = 1/137.0359895
Ia ditakrifkan sebagai kuota antara beban elektron dan Saya tinggi persegi, dan produk antara pemalar Planck h dan kelajuan cahaya c Dalam vakum, semuanya didarab dengan 2π:
α = 2π (e2/h.c) = 1/137.0359895
Struktur halus yang tetap berkaitan tiga pemalar yang paling penting dalam fizik atom. Yang lain adalah jisim elektron, yang tidak muncul di sini.
Dengan cara ini ia dikaitkan dengan elektron dengan foton (yang bergerak pada kelajuan c dalam kekosongan), dan dengan itu menjelaskan penyimpangan beberapa garis spektrum atom hidrogen ramalan oleh model Bohr.
Terima kasih kepada pembetulan relativistik, tahap tenaga dengan sama n Tetapi berbeza L Mereka memisahkan, menimbulkan struktur struktur halus, dari situ nama α pemalar.
Dan semua panjang ciri atom dapat dinyatakan dari segi pemalar ini.
 Rajah 4. Kuantisasi momentum sudut l ditunjukkan. Tidak seperti orbit bulat, elips. Sumber: f. Zapata.
Rajah 4. Kuantisasi momentum sudut l ditunjukkan. Tidak seperti orbit bulat, elips. Sumber: f. Zapata. Kelebihan dan kekurangan
Kelebihan
-Sommerfeld menunjukkan bahawa nombor kuantum tunggal tidak mencukupi untuk menerangkan garis spektrum atom hidrogen.
-Ini adalah model pertama untuk mencadangkan kuantisasi spatial, kerana unjuran orbit ke arah medan elektromagnet, berkuat kuasa, dikira.
Boleh melayani anda: keadaan plasma: ciri, jenis dan contoh-Model Sommerfeld dengan memuaskan menjelaskan bahawa elektron dengan nombor kuantum utama yang sama n berbeza dalam keadaan tenaga mereka, kerana mereka boleh mempunyai bilangan kuantum yang berbeza l dan mL.
-Memperkenalkan α pemalar untuk membangunkan struktur halus spektrum atom dan menjelaskan kesan zeeman.
-Ia termasuk kesan relativistik, kerana elektron dapat bergerak dengan kelajuan yang cukup dekat dengan cahaya.
Kekurangan
-Modelnya hanya terpakai kepada atom dengan elektron dan dalam banyak cara untuk atom logam alkali seperti Li2+, Tetapi ia tidak berguna dalam atom helium, yang mempunyai dua elektron.
-Tidak menjelaskan pengedaran elektronik dalam atom.
-Model yang dibenarkan untuk mengira tenaga negara -negara yang dibenarkan dan frekuensi radiasi yang dikeluarkan atau diserap dalam peralihan antara negeri -negeri, tanpa memberi maklumat mengenai masa peralihan ini.
-Sekarang diketahui bahawa elektron tidak mengikuti trajektori dengan bentuk yang telah ditetapkan sebagai orbit, tetapi mereka menduduki Orbital, Kawasan ruang yang sepadan dengan penyelesaian persamaan Schrodinger.
-Model sewenang -wenangnya menggabungkan aspek klasik dengan aspek kuantum.
-Dia gagal menjelaskan kesan zeeman anomali, kerana ini diperlukan oleh model Dirac, yang kemudiannya menambah nombor kuantum lain.
Artikel yang menarik
Model atom Schrödinger.
Model Broglie Atom.
Model Atom Chadwick.
Model Atom Heisenberg.
Model atom Perrin.
Model Thomson Atom.
Model Atom Dalton.
Model Atom Dirac Jordan.
Model Atom Leucipo.
Model Atom Bohr.
Model atom semasa.
Rujukan
- Brainkart. Model atom Sommerfeld dan kelemahannya. Pulih dari: Brainkart.com.
- Bagaimana kita mengetahui kosmos: cahaya & perkara. Atom Sommerfeld. Diperolehi dari: Tastargarden.co.UK
- Parker, ms. Atom Bohr-Sommerfeld. Pulih dari: Physnet.org
- Sudut Pendidikan. Model Sommerfeld. Pulih dari: rinconucative.com.
- Wikipedia. Model atom Sommerfeld. Pulih dari: Adakah.Wikipedia, Org.

