Ciri -ciri Model Atom Thomson, Postulates, Zarah Subatomik
- 2470
- 68
- Ismael Turner
Dia Model Thomson Atom Ia dicipta oleh jejak fizikal bahasa Inggeris J. J. Thomson, yang menemui elektron. Oleh kerana penemuan ini dan karya -karyanya mengenai pengaliran elektrik dalam gas, ia diberikan pada tahun 1906 dengan Hadiah Nobel dalam Fizik.
Dari kerjanya dengan sinar katod, ia telah mendedahkan bahawa atom itu bukan entiti yang tidak dapat dipisahkan, seperti yang dikatakan oleh Dalton dalam model sebelumnya, tetapi ia mengandungi struktur dalaman yang ditentukan dengan baik.

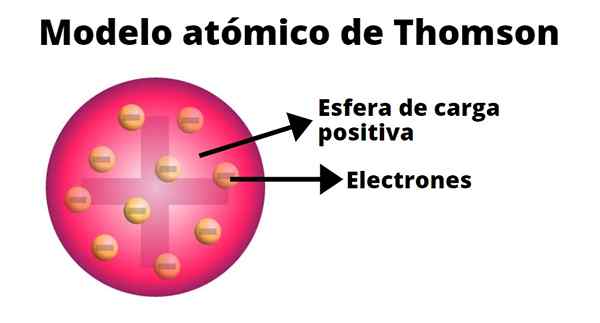
Thomson membangunkan model atom berdasarkan hasil eksperimennya dengan sinar katod. Di dalamnya, dia mengesahkan bahawa atom, elektrik neutral, terbentuk daripada caj positif dan negatif yang sama dengan magnitud.
[TOC]
Apakah nama model atom Thomson dan mengapa?
Menurut Thomson, beban positif diedarkan di seluruh atom dan caj negatif tertanam di dalamnya seolah -olah mereka adalah kismis puding. Dari perbandingan ini, istilah "puding kismis" muncul, kerana model itu tidak dikenali.
 Joseph John Thomson
Joseph John Thomson Walaupun idea Thomson kini agak primitif, untuk waktunya dia mewakili sumbangan baru. Semasa kesahihan ringkas model (dari 1904 hingga 1910), beliau mendapat sokongan ramai saintis, walaupun banyak yang lain menganggapnya sebagai bidaah.
Akhirnya pada tahun 1910 bukti baru muncul mengenai struktur atom dan model Thomson dengan cepat tetap mengetepikan. Ini berlaku sebaik sahaja Rutherford menerbitkan hasil eksperimen penyebarannya, yang menunjukkan kewujudan nukleus atom.
Walau bagaimanapun, model Thomson adalah yang pertama untuk merumuskan kewujudan zarah subatomik dan hasilnya adalah buah percubaan halus dan ketat. Dengan cara ini dia menubuhkan duluan untuk semua penemuan yang diikuti.
Ciri -ciri dan postulates model Thomson
Thomson tiba di model atomnya berdasarkan beberapa pemerhatian. Yang pertama adalah bahawa X -Rays yang baru ditemui oleh Roentgen dapat mengionkan molekul udara. Sehingga itu, satu -satunya cara untuk mengion adalah secara kimia memisahkan ion ke dalam penyelesaian.
Tetapi ahli fizik Inggeris berjaya mengionkan gas monoatomik seperti helium, melalui x -rays. Ini menyebabkan dia percaya bahawa beban di dalam atom dapat dipisahkan, dan oleh itu ia tidak dapat dipisahkan.Dia juga memerhatikan bahawa sinar katod dapat dialihkan oleh medan elektrik dan magnet.
 J.J. Thomson, penemu elektron. Sumber: Lafer.
J.J. Thomson, penemu elektron. Sumber: Lafer. Kemudian Thomson mencipta model yang betul menjelaskan fakta bahawa atom secara elektrik neutral dan sinar katod terdiri daripada zarah dengan beban negatif.
Mengukur bukti eksperimen, Thomson mencirikan atom seperti berikut:
-Atom adalah sfera pepejal neutral elektrik, dengan radius anggaran 10-10 m.
-Beban positif diedarkan lebih kurang seragam oleh sfera.
-Atom mengandungi "corpuscles" yang dimuatkan secara negatif, yang memastikan berkecuali mereka.
-Corpuscles ini sama untuk semua perkara.
-Apabila atom seimbang, ada n Corpuscles yang kerap disusun dalam cincin dalam lingkungan beban positif.
-Jisim atom diedarkan secara seragam.
Sinar katod
 Rasuk elektron diarahkan dari katod ke anod.
Rasuk elektron diarahkan dari katod ke anod. Thomson menjalankan eksperimennya menggunakan sinar katod, ditemui pada tahun 1859. Sinar Katod adalah zarah yang dikenakan secara negatif. Untuk menghasilkannya, tiub kristal vakum digunakan, di mana dua elektrod diletakkan, dipanggil Katod dan anod.
Boleh melayani anda: Magnetisme: Sifat Magnet Bahan, KegunaanKemudian arus elektrik diluluskan yang memanaskan katod, yang dengan itu memancarkan radiasi yang tidak kelihatan yang diarahkan terus ke elektrod yang bertentangan.
Untuk mengesan radiasi, yang tidak lain selain sinaran katod, dinding tiub ditutup dengan bahan pendarfluor. Apabila radiasi datang ke sana, dinding tiub mengeluarkan kilauan yang sengit.
Sekiranya objek pepejal diikat di jalan sinaran katod, ia melemparkan bayangan di dinding tiub. Ini menunjukkan bahawa sinar bergerak dalam garis lurus, dan juga bahawa mereka dapat dengan mudah menyekat mereka.
Sifat sinar katod dibincangkan secara meluas, kerana sifatnya tidak diketahui. Ada yang menyangka mereka adalah gelombang elektromagnetik, sementara yang lain berpendapat bahawa mereka adalah zarah.
Zarah subatomik Model Thomson Atom
Model atom Thomson adalah, seperti yang kita katakan, yang pertama untuk merumuskan kewujudan zarah subatomik. Corpuscles Thomson tidak lain selain elektron, zarah asas atom yang dimuatkan secara negatif.
Pada masa ini kita tahu bahawa dua zarah asas yang lain adalah proton, dimuat secara positif, dan neutron tanpa beban.
Tetapi ini tidak ditemui pada masa Thomson menghuraikan modelnya. Tuduhan positif dalam atom diedarkan di dalamnya, tidak menganggap mana -mana zarah yang dibawa beban tersebut dan pada masa ini tidak ada bukti kewujudannya.
Atas sebab ini, modelnya mempunyai kewujudan yang singkat, sejak dalam beberapa tahun, eksperimen penyebaran Rutherford membuka jalan untuk penemuan proton. Dan bagi neutron, Rutherford sendiri mencadangkan kewujudannya beberapa tahun sebelum dia akhirnya ditemui.
Tiub Crookes
Sir William Crookes (1832-1919) merancang tiub yang menanggung namanya sekitar tahun 1870, dengan niat untuk mengkaji dengan teliti sifat sinar katod. Beliau menambah medan elektrik dan medan magnet, dan memerhatikan bahawa sinar telah dialihkan oleh ini.
 Skim tiub sinar katod. Sumber: Knight, r.
Skim tiub sinar katod. Sumber: Knight, r. Dengan cara ini, Crookes dan penyelidik lain, termasuk Thomson, mendapati bahawa:
- Arus elektrik dihasilkan di dalam tiub sinar katod
- Sinar -sinaran itu menyimpang dengan kehadiran medan magnet, dengan cara yang sama bahawa zarah -zarah yang dikenakan negatif.
- Mana -mana logam yang digunakan untuk mengeluarkan katod sama baiknya untuk menghasilkan sinar katod, dan tingkah laku mereka bebas daripada bahan tersebut.
Pemerhatian ini mendorong perbincangan di sekitar asal -usul sinar katod. Mereka yang berpendapat bahawa mereka adalah gelombang berdasarkan fakta bahawa sinar katod dapat bergerak dalam garis lurus. Di samping itu, hipotesis ini menjelaskan dengan baik bayangan bahawa objek pepejal yang dilemparkan di dinding tiub dan dalam keadaan tertentu, diketahui bahawa gelombang boleh menyebabkan pendarfluor.
Tetapi sebaliknya tidak difahami bagaimana mungkin medan magnet mengalihkan sinar katod. Ini hanya mempunyai penjelasan jika sinaran ini dianggap sebagai zarah, hipotesis yang dikongsi Thomson.
Zarah dimuatkan dalam medan elektrik dan magnet seragam
Zarah yang dimuatkan dengan beban Q, mengalami daya iman di tengah -tengah medan elektrik seragam dan, magnitud:
Boleh melayani anda: Teori cahaya yang beralun: penjelasan, aplikasi, contohIman = Qe
Apabila zarah yang dimuatkan secara serentak melintasi medan elektrik seragam, seperti yang berlaku di antara dua plat dengan beban yang bertentangan, ia mengalami sisihan, dan oleh itu percepatan:
qe = ma
a = qe/m
Sebaliknya, jika zarah yang dimuatkan bergerak dengan kelajuan magnitud V, di tengah -tengah medan magnet seragam magnitud B, daya magnet FM yang mengalami intensiti berikut:
FM = QVB
Selagi kelajuan dan vektor medan magnet berserenjang. Apabila zarah yang dimuatkan mempengaruhi tegak lurus dalam medan magnet homogen, ia juga mengalami sisihan dan pergerakannya seragam pekeliling.
Pecutan centripetal kec Dalam kes ini ia adalah:
Qvb = mac
Sebaliknya, pecutan sentripetal berkaitan dengan kelajuan zarah V dan radius r trajektori bulat:
kec = v2/R
Oleh itu:
Qvb = mv2/R
Radius trajektori bulat boleh dikira seperti berikut:
R = mv/qb
Kemudian persamaan ini akan digunakan untuk mencipta semula cara Thomson menyimpulkan nisbah beban elektron.
Percubaan Thomson
Thomson melepasi sinar sinar katod, rasuk elektron, walaupun dia masih tidak tahu, melalui medan elektrik seragam. Bidang ini dibuat antara dua plat konduktif yang dimuatkan dan dipisahkan pada jarak yang kecil.
Sinar Katod juga melalui medan magnet seragam, memerhatikan kesan yang ada pada rasuk. Kedua -duanya dalam satu bidang dan yang lain, terdapat pesongan di sinar, yang menyebabkan Thomson berfikir, betul, bahawa rasuk itu terdiri daripada zarah yang dikenakan.
Untuk memeriksa, Thomson menjalankan beberapa strategi dengan sinar katod:
- Berbeza medan elektrik dan magnet sehingga daya dibatalkan. Dengan cara ini, sinar katod berlalu tanpa pesongan. Memadankan kuasa elektrik dan magnet, Thomson berjaya menentukan kelajuan zarah rasuk.
- Membatalkan intensiti medan elektrik, dengan cara ini zarah -zarah mengikuti trajektori bulat di tengah -tengah medan magnet.
- Menggabungkan hasil langkah 1 dan 2 untuk menentukan nisbah beban-enty "korpuscles".
Nisbah massa kargo elektron
Thomson memutuskan bahawa nisbah kargo-mandy zarah-zarah yang membentuk rasuk sinar katod mempunyai nilai berikut:
Q/m = 1.758820 x 10 11 c.kg-1.
Di mana q mewakili beban "corpuscle", yang sebenarnya elektron dan m Ia adalah jisim yang sama. Thomson mengikuti prosedur yang diterangkan di bahagian sebelumnya, yang kami buat semula di sini langkah demi langkah, dengan persamaan yang digunakannya.
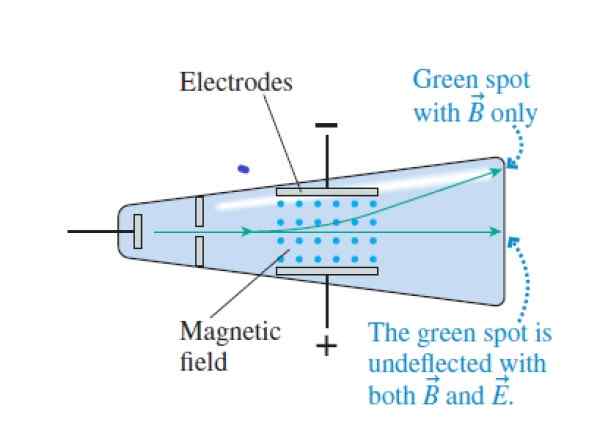 Apabila sinar katod melintasi medan salib dan magnet, mereka lulus tanpa pesongan. Apabila medan elektrik dibatalkan, ia menjejaskan bahagian atas tiub (medan magnet ditunjukkan dengan titik biru antara elektrod). Sumber: Knight, r.
Apabila sinar katod melintasi medan salib dan magnet, mereka lulus tanpa pesongan. Apabila medan elektrik dibatalkan, ia menjejaskan bahagian atas tiub (medan magnet ditunjukkan dengan titik biru antara elektrod). Sumber: Knight, r. Langkah 1
Padankan daya elektrik dan daya magnet, lulus rasuk melalui medan elektrik dan magnet tegak lurus:
Qvb = qe
Langkah 2
Tentukan kelajuan yang diperoleh oleh zarah rasuk apabila mereka lulus secara langsung tanpa pesongan:
V = e/b
Langkah 3
Batalkan medan elektrik, hanya meninggalkan medan magnet (sekarang ada pesongan):
R = mv/qb
Dengan hasil v = e/b:
R = saya/qb2
Radius orbit boleh diukur, oleh itu:
Q/m = v/rb
Wahai:
Q/m = e/rb2
Langkah seterusnya
Perkara seterusnya yang dilakukan oleh Thomson adalah mengukur Q/M quotient menggunakan katod yang diperbuat daripada bahan yang berbeza. Seperti yang dinyatakan di atas, semua logam memancarkan sinar katod dengan ciri -ciri yang sama.
Boleh melayani anda: reaksi induktifKemudian Thomson membandingkan nilai -nilainya dengan nisbah Q/M dari ion hidrogen, yang diperolehi oleh elektrolisis dan nilainya adalah kira -kira 1 x 108 C/kg. Kuasa beban elektron-masa adalah lebih kurang 1750 kali lebih besar daripada ion hidrogen.
Oleh itu sinar katod mempunyai beban yang lebih besar, atau mungkin jisim jauh lebih kecil daripada ion hidrogen. Ion hidrogen hanyalah proton, yang kewujudannya diketahui masa selepas eksperimen penyebaran Rutherford.
Hari ini diketahui bahawa proton hampir 1800 kali lebih besar daripada elektron dan dengan beban magnitud yang sama dan menandatangani bertentangan dengan elektron.
Satu lagi perincian penting ialah dengan eksperimen Thomson, caj elektrik elektron tidak ditentukan, atau nilai jisimnya secara berasingan. Nilai -nilai ini ditentukan melalui eksperimen Millikan, yang bermula pada tahun 1906.
Perbezaan model Thomson dan Dalton
Perbezaan asas kedua -dua model ini ialah Dalton berpendapat bahawa atom adalah sfera. Bertentangan dengan Thomson, dia tidak mencadangkan kewujudan caj positif atau negatif. Untuk Dalton A Atom seperti ini:
 Dalton Atom
Dalton Atom Seperti yang telah kita lihat sebelumnya, Thomson berpendapat bahawa atom itu boleh dibahagikan, dan strukturnya dibentuk oleh sfera positif dan elektron di sekitar.
Kegagalan dan batasan model
Pada masa itu, model atom Thomson berjaya menjelaskan tingkah laku bahan kimia dengan baik. Dia juga menerangkan fenomena yang berlaku di tiub sinar katod.
Tetapi sebenarnya Thomson tidak memanggil zarah "elektron" nya, walaupun istilah itu telah dicipta oleh George Johnstone Stoney. Thomson hanya memanggil mereka "Corpuscles".
Walaupun Thomson menggunakan semua pengetahuan yang dia ada buat masa ini, terdapat beberapa batasan penting dalam modelnya, yang jelas tidak lama lagi:
-Beban positif tidak diedarkan di seluruh atom. Eksperimen penyebaran Rutherford menunjukkan bahawa beban positif atom semestinya terhad kepada kawasan kecil itu, yang kemudiannya dikenali sebagai nukleus atom.
-Elektron mempunyai taburan tertentu dalam setiap atom. Elektron tidak diedarkan secara seragam, seperti kismis Buddine yang terkenal, tetapi mempunyai pelupusan dalam orbital yang menunjukkan model berikutnya.
Ini adalah pelupusan elektron dalam atom yang membolehkan menganjurkan unsur -unsur untuk ciri -ciri dan sifat mereka dalam jadual berkala. Ini adalah batasan penting model Thomson, yang tidak dapat menjelaskan bagaimana mungkin untuk memerintahkan unsur -unsur dengan cara ini.
-Nukleus atom adalah yang mengandungi kebanyakan adunan. Model Thomson mengandaikan bahawa jisim atom itu diedarkan secara seragam di dalamnya. Tetapi hari ini kita tahu bahawa jisim atom praktikal tertumpu dalam proton dan neutron nukleus.
Ia juga penting untuk menyerlahkan bahawa model atom ini tidak membenarkan menyimpulkan jenis pergerakan yang dimiliki oleh elektron dalam atom.
Artikel yang menarik
Model atom Schrödinger.
Model Broglie Atom.
Model Atom Chadwick.
Model Atom Heisenberg.
Model atom Perrin.
Model Atom Dalton.
Model Atom Dirac Jordan.
Model Atom Democritus.
Model Atom Leucipo.
Model Atom Bohr.
Model atom Sommerfeld.
Model atom semasa.
Rujukan
- Andriessen, m. 2001. Kursus HSC. Fizik 2. Sains Jacaranda HSC.
- Arfken, g. 1984. Fizik Universiti. Akhbar Akademik.
- Knight, r. 2017. Fizik untuk saintis dan kejuruteraan: Pendekatan Strategi. Pearson.
- Rex, a. 2011. Asas Fizik. Pearson.
- Wikipedia. Model Thomson Atom. Pulih dari: ia adalah.Wikipedia.org.

