Nitrat tembaga (ii)
- 3357
- 937
- Ismael Turner
 Formula dan struktur nitrat tembaga (ii)
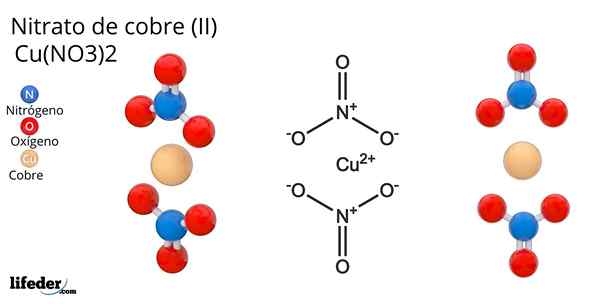
Formula dan struktur nitrat tembaga (ii) Dia Nitrat tembaga (Ii) atau nitrat cuprik, yang formula kimianya adalah Cu (tidak3)2, Ia adalah garam anorganik yang cemerlang dan warna biru-hijau yang menarik. Ia disintesis pada skala perindustrian dari penguraian mineral tembaga, termasuk mineral Gerhardita dan Rouaita.
Kaedah lain yang lebih baik, dari segi bahan mentah dan jumlah garam yang dikehendaki, terdiri daripada tindak balas langsung dengan tembaga logam dan sebatiannya. Apabila tembaga bersentuhan dengan larutan asid nitrik pekat (HNO3), tindak balas redoks berlaku.
Dalam reaksi ini, tembaga mengoksidakan dan nitrogen dikurangkan mengikut persamaan kimia berikut:
Cu (s) + 4hno3(conc) => cu (tidak3)2(Ac) + 2h2Atau (l) + 2no2(g)
Nitrogen dioksida (tidak2) adalah gas coklat dan berbahaya; Penyelesaian berair yang terhasil adalah kebiruan. Tembaga boleh membentuk ion cuprous (CU+), Ion cuprik (CU2+) atau cu ion paling tidak biasa3+; Walau bagaimanapun, ion cuprous tidak disukai dalam media berair oleh banyak faktor elektronik, tenaga dan geometri.
Potensi pengurangan standard untuk CU+ (0.52v) lebih besar daripada CU2+ (0.34V), yang bermaksud bahawa CU+ Lebih tidak stabil dan cenderung memenangi elektron untuk menjadi Cu (s). Langkah elektrokimia ini menerangkan mengapa tidak ada cuno3 sebagai produk tindak balas, atau sekurang -kurangnya di dalam air.
[TOC]
Sifat nitrat tembaga
 Penampilan nitrat tembaga (ii) triohydrate
Penampilan nitrat tembaga (ii) triohydrate Nitrat tembaga adalah anhidrida (kering) atau terhidrasi dengan kadar air yang berbeza. Anhydride adalah cecair biru, tetapi selepas menyelaraskan dengan molekul air - mampu membentuk jambatan hidrogen - mengkristal bagaimana Cu (tidak3)2· 3h2O o cu (tidak3)2· 6h2Sama ada. Ini adalah tiga bentuk garam yang paling banyak ada di pasaran.
Ia boleh melayani anda: Helmholtz Tenaga Percuma: Unit, Bagaimana Ia Dikira, Latihan DiselesaikanBerat molekul untuk garam kering adalah 187.6 g/mol, menambah nilai ini 18 g/mol untuk setiap molekul air dimasukkan ke dalam garam. Ketumpatannya sama dengan 3.05 g/ml, dan ia berkurangan oleh setiap molekul air terbina dalam: 2.32 g/ml untuk garam tri-hidrasi, dan 2.07 g/ml untuk garam hexa yang terhidrasi. Ia tidak mempunyai titik mendidih, tetapi Sublima.
Tiga bentuk nitrat tembaga sangat larut dalam air, ammonia, dioksana dan etanol. Titik leburnya turun kerana molekul lain ditambah ke sfera koordinasi luaran tembaga; Gabungan diikuti oleh penguraian haba nitrat tembaga, menghasilkan gas berbahaya tanpa2:
2 cu (tidak3)2(s) => 2 cuo (s) + 4 tidak2(g)+ atau2(g)
Persamaan kimia di atas adalah untuk garam anhidrida; Untuk garam terhidrat, wap air juga akan berlaku di sebelah kanan persamaan.
Konfigurasi Elektronik
Konfigurasi Elektronik untuk Ion Cu2+ Ia adalah [ar] 3d9, Membentangkan Paramagnetisme (elektron dalam orbital 3d9 hilang).
Sebagai tembaga adalah logam peralihan pada tempoh keempat jadual berkala, dan kehilangan dua elektron Valencia setiap tindakan HNO3, Ia masih mempunyai orbital 4s dan 4p yang tersedia untuk membentuk ikatan kovalen. Lebih -lebih lagi, CU2+ Anda boleh menggunakan dua orbital 4D paling luarnya untuk dapat menyelaraskan sehingga enam molekul.
Anion no3- Mereka rata, dan untuk CU2+ Anda boleh menyelaras dengan mereka mesti mempunyai hibridisasi SP3d2 Itu membolehkan anda menggunakan geometri octahedral; Ini menghalang anion daripada tidak3- Jadilah "memukul" di antara mereka.
Ia boleh melayani anda: Formula Pekat: Apakah dan Contoh (Metana, Etana, Glukosa ...)Ini dicapai oleh CU2+, meletakkan mereka dalam satah persegi di sekelilingnya. Konfigurasi yang dihasilkan untuk atom Cu dalam garam adalah: [ar] 3d94s24p6.
Struktur kimia
 Struktur nitrat tembaga (ii)
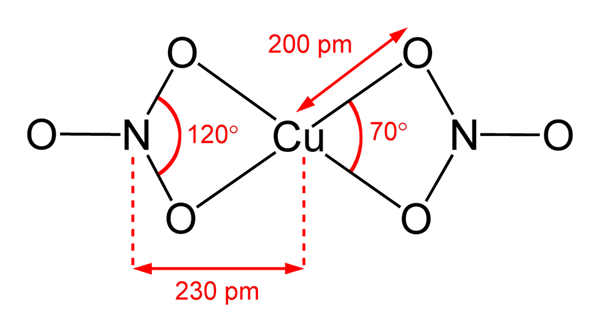
Struktur nitrat tembaga (ii) Dalam imej unggul, molekul terpencil Cu diwakili (tidak3)2 dalam fasa gas. Atom oksigen anion nitrat diselaraskan secara langsung dengan pusat tembaga (sfera koordinasi dalaman), membentuk empat ikatan Cu-O.
Ia mempunyai geometri molekul pesawat persegi. Satah ditarik oleh sfera merah di simpul dan sfera tembaga di tengah. Interaksi fasa gas sangat lemah kerana penolakan elektrostatik antara kumpulan tidak3-.
Walau bagaimanapun, dalam fasa pepejal pusat tembaga membentuk pautan logam -cu-cu-, mewujudkan rantai coppery polimer.
Molekul air boleh membentuk jambatan hidrogen dengan kumpulan tidak3-, dan ini akan menawarkan jambatan hidrogen untuk molekul air lain, dan sebagainya sehingga sfera air di sekitar Cu (tidak3)2.
Dalam bidang ini ia boleh mempunyai 1 hingga 6 jiran luar; Oleh itu garam mudah terhidrasi untuk menjana garam tri dan hexa terhidrasi.
Garam terbentuk dari ion cu2+ dan dua ion no3-, Memberi ciri kristalitas ciri -ciri sebatian ionik (ortorrombic untuk garam anhydrid, rhomboédica untuk garam terhidrat). Walau bagaimanapun, pautan adalah watak kovalen yang lebih besar.
Penggunaan/aplikasi
Untuk warna nitrat tembaga yang menarik, garam ini dapat digunakan sebagai aditif dalam seramik, pada permukaan logam, dalam beberapa bunga api dan juga dalam industri tekstil sebagai mordant.
Boleh melayani anda: entalpiIni adalah sumber ionik yang baik untuk banyak reaksi, terutama yang di mana ia memangkinkan tindak balas organik. Ia juga mendapati kegunaan serupa dengan nitrat lain, sama ada sebagai fungisida, herbisida atau sebagai pengawet kayu.
Satu lagi kegunaan utama dan paling baru adalah dalam sintesis pemangkin CuO, atau bahan dengan kualiti photosensitif.
Ia juga digunakan sebagai reagen klasik dalam makmal pengajaran untuk menunjukkan reaksi di dalam sel voltaik.
Risiko
- Ia adalah ejen pengoksidaan yang kuat, berbahaya kepada ekosistem laut, menjengkelkan, toksik dan menghakis. Penting untuk mengelakkan semua hubungan fizikal secara langsung dengan reagen.
- Ia tidak mudah terbakar.
- Ia terurai pada suhu tinggi yang melepaskan gas yang menjengkelkan, antara ini2.
- Dalam organisma manusia, ia dapat menyebabkan kerosakan kronik ke sistem kardiovaskular dan saraf pusat.
- Boleh menyebabkan kerengsaan di saluran gastrousus.
- Menjadi nitrat, di dalam badan ia menjadi nitrit. Nitrite menimbulkan kemusnahan dalam tahap oksigen dalam darah dan dalam sistem kardiovaskular.
Rujukan
- Hari, r., & Underwood, a. Kimia Analisis Kuantitatif (Kelima ed.). Pearson Prentice Hall, P-810.
- Sains Mel. (2015-2017). Sains Mel. Pulih dari Mel Science: Melscience.com
- ResearchGate GmbH. (2008-2018). Penyelidikan. Pulih dari Penyelidikan: Penyelidikan.jaring
- Makmal sains. Makmal sains. Pulih dari Makmal Sains: Sciencelab.com
- Whitten, Davis, Peck, & Stanley. (2008). Kimia (Kelapan ed.). P-321. Pembelajaran Cengage.
- Wikipedia. Wikipedia. Wikipedia pulih: masuk.Wikipedia.org

