Struktur, AgNO3) Struktur, sifat, kegunaan, ketoksikan,

- 3861
- 993
- Horace Gulgowski
Dia nitrat perak Ia adalah garam bukan organik yang formula kimia adalah agno3. Dari semua garam perak, ia adalah yang paling ekonomik dan yang membentangkan kestabilan relatif terhadap cahaya matahari, jadi ia cenderung kurang untuk mengurai. Ia adalah sumber perak yang larut dan membangkitkan dalam setiap makmal pengajaran atau penyelidikan.
Dalam pengajaran, penyelesaian nitrat perak berair digunakan untuk mengajar reaksi pemendakan klorida perak. Begitu juga, penyelesaian ini bersentuhan dengan tembaga logam untuk mengambil reaksi Rédox, di mana perak logam mendahului di tengah -tengah pembubaran nitrat tembaga yang terbentuk, Cu (tidak3)2.
 Bekas sampel nitrat perak. Sumber: w. OELEN/CC BY-SA (https: // creativeCommons.Org/lesen/by-sa/3.0)
Bekas sampel nitrat perak. Sumber: w. OELEN/CC BY-SA (https: // creativeCommons.Org/lesen/by-sa/3.0) Di bahagian atas gambar botol dengan nitrat perak ditunjukkan. Ia boleh disimpan terdedah kepada cahaya tanpa segera gelap kristalnya, produk penampilan oksida perak.
Berikutan adat istiadat alkimia, dan sifat antibakteria perak logam, nitrat perak telah digunakan untuk membasmi kuman dan cauterize luka. Walau bagaimanapun, untuk tujuan ini penyelesaian berair yang sangat dicairkan digunakan, atau pepejalnya bercampur dengan kalium nitrat yang digunakan oleh hujung batang kayu.
[TOC]
Struktur nitrat perak
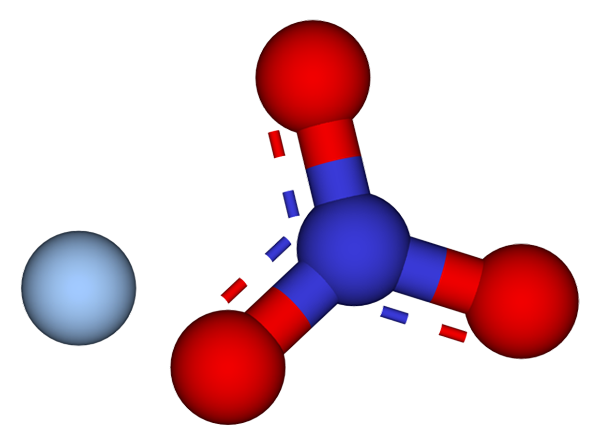 Ion yang membentuk kristal nitrat perak. Sumber: CCOIL/CC BY-SA (https: // creativeCommons.Org/lesen/by-sa/3.0)
Ion yang membentuk kristal nitrat perak. Sumber: CCOIL/CC BY-SA (https: // creativeCommons.Org/lesen/by-sa/3.0) Di bahagian atas, ion ag ditunjukkan+ dan tidak3- nitrat perak, yang diwakili oleh model sfera dan bar. Formula Agno3 Menunjukkan perkadaran stoikiometrik garam ini: untuk setiap kation ag+ Ada anion tidak3- berinteraksi dengannya secara elektrostatik.
Ia boleh melayani anda: sulfur: sejarah, sifat, struktur, mendapatkan, menggunakanAnion no3- (sfera merah dan kebiruan) mempunyai geometri rata trigonal, dengan beban negatif yang meremehkan antara tiga atom oksigennya. Oleh itu, interaksi elektrostatik antara kedua -dua ion berlaku secara khusus antara kation Ag+ dan atom oksigen anion tidak3- (Ag+-ATAU TIDAK2-).
Dengan cara ini, setiap AG+ berakhir dengan menyelaras atau sekitar tiga no3- bersebelahan dengan satah yang sama atau lapisan kristal. Pengumpulan pesawat ini berakhir dengan menentukan kristal yang strukturnya adalah ortorrombik.
Penyediaan
Nitrat perak disediakan dengan menyerang sekeping perak logam yang dibakar dengan asid nitrik, sama ada sejuk, atau pekat panas:
3 AG + 4 HNO3 (dicairkan) → 3 Agno3 + 2 jam2O +tidak
AG + 2 HNO3 (tertumpu) → AGNO3 + H2O +tidak2
Perhatikan pembentukan gas tidak dan tidak2, yang beracun, dan memaksa tindak balas ini tidak akan dilakukan di luar loceng pengekstrak.
Sifat fizikal dan kimia
Penampilan fizikal
Pepejal kristal tanpa warna, tandas, tetapi rasa sangat pahit.
Jisim molar
169,872 g/mol
Takat lebur
209.7 ºC
Takat didih
440 ºC. Walau bagaimanapun, pada suhu ini mengalami penguraian terma, di mana perak logam berlaku:
2 Agno3(l) → 2 Ag (s) + o2 (g) + 2 Tidak2 (g)
Tidak ada wap agno3, Sekurang -kurangnya tidak berada dalam keadaan daratan.
Kelarutan
Agno3 Ia adalah penjimatan air yang sangat larut, mempunyai kelarutan 256 g/ 100 ml pada 25 ° C. Ia juga larut dalam pelarut kutub lain seperti ammonia, asid asetik, aseton, eter dan gliserol.
Ketumpatan
4.35 g/cm3 pada 24 ºC (suhu ambien)
Boleh melayani anda: air suling3.97 g/cm3 pada 210 ºC (hanya di titik lebur)
Kestabilan
Agno3 Ia adalah bahan yang stabil setiap kali disimpan dengan betul. Ia tidak akan menjadi meradang pada suhu, walaupun ia boleh dipecahkan dengan melepaskan asap toksik nitrogen oksida.
Sebaliknya, walaupun nitrat perak tidak mudah terbakar, ia adalah ejen pengoksidaan yang kuat yang, ketika bersentuhan dengan bahan organik dan sumber haba, dapat mencetuskan reaksi eksotermik dan letupan.
Di samping itu, garam ini tidak boleh didedahkan terlalu banyak masa untuk cahaya matahari, kerana kristal mereka gelap kerana pembentukan oksida perak.
Penggunaan nitrat perak
Ejen prokit dan analisis
Di bahagian sebelumnya, sebutkan kelarutan yang luar biasa dari Agno telah dibuat3 Dalam air. Ini menunjukkan bahawa ag ion+ Mereka akan larut tanpa sebarang masalah dan akan tersedia untuk berinteraksi dengan mana -mana ion sederhana berair, seperti anion halogenida (x = f-, Cl-, Br- dan saya-).
Perak sebagai ag+, Dan selepas penambahan HNO3 dicairkan, mencetuskan fluorida, klorida, bromida dan iodida yang hadir, yang terdiri daripada pepejal putih atau kekuningan:
Ag+(ac) +x-(Ac) → AGX (s)
Teknik ini sangat berulang untuk mendapatkan halogenuros, dan juga digunakan dalam banyak kaedah analisis kuantitatif.
Reagen Tollens
Agno3 Ia juga memainkan peranan analisis dalam kimia organik, kerana ia adalah reagen utama, bersebelahan dengan ammonia, untuk penyediaan reagen Tollens. Reagen ini digunakan dalam ujian kualitatif yang membolehkan untuk menentukan kehadiran aldehid dan keton dalam sampel masalah.
Sintesis
Agno3 Ia adalah sumber ion perak larut yang sangat baik. Ini, sebagai tambahan kepada kos relatif dan rendahnya, menjadikannya reagen yang diminta untuk sintesis organik dan bukan organik yang banyak.
Ia boleh melayani anda: Gibbs Free Energy: Units, Bagaimana Ia Dikira, Latihan DiselesaikanApa sahaja reaksi, jika anda memerlukan ion ag+, Oleh itu, kemungkinan besar bahan kimia menggunakan agno3.
Ubat
Agno3 Dia mempunyai banyak populariti dalam bidang perubatan sebelum kemunculan antibiotik moden. Hari ini, bagaimanapun, ia masih digunakan untuk kes -kes tertentu, kerana ia mempunyai sifat -sifat caulster dan antibakteria.
Biasanya, ia bercampur dengan KNO3 Di hujung batang kayu, supaya ia dikhaskan secara eksklusif untuk kegunaan topikal. Dalam pengertian ini, ia telah berkhidmat untuk rawatan ketuat, luka, kuku yang dijangkiti, ulser mulut hidung dan pendarahan. Campuran Agno3-Kno3 Cauteriza Kulit memusnahkan tisu dan bakteria yang rosak.
Tindakan bakterisida Agno3 Ia juga telah digunakan dalam pembersihan air.
Ketoksikan dan kesan sampingan
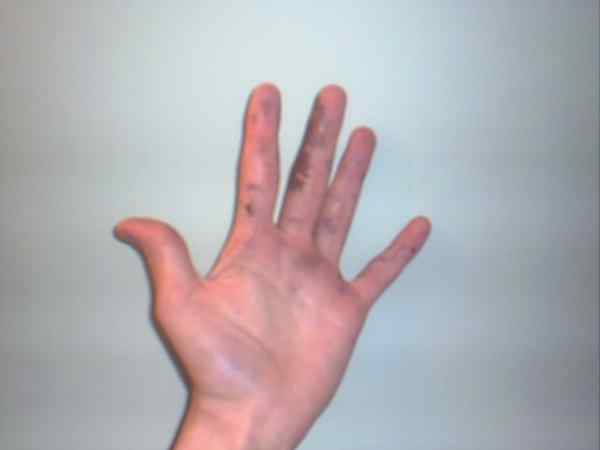 Nitrat perak boleh menyebabkan luka bakar yang dipaparkan oleh bintik ungu atau gelap mereka. Sumber: Jane of Baden di Bahasa Inggeris Wikipedia / Domain Awam
Nitrat perak boleh menyebabkan luka bakar yang dipaparkan oleh bintik ungu atau gelap mereka. Sumber: Jane of Baden di Bahasa Inggeris Wikipedia / Domain Awam Walaupun nitrat perak adalah gaji yang stabil dan tidak mewakili terlalu banyak risiko, ia adalah pepejal yang sangat kaustik, yang pengambilannya boleh menyebabkan kerosakan gastrousus yang teruk.
Itulah sebabnya manipulasi dengan sarung tangan disyorkan. Ia boleh membakar kulit, dan dalam beberapa kes, menggelapkannya sehingga ia mengubah keadaan ungu, keadaan atau penyakit yang dikenali sebagai Argiria.
Rujukan
- Shiver & Atkins. (2008). Kimia bukan organik. (Edisi Keempat). MC Graw Hill.
- Wikipedia. (2020). Nitrat perak. Diperoleh dari: dalam.Wikipedia.org
- Pusat Kebangsaan Maklumat Bioteknologi. (2020). Nitrat perak. Pangkalan data PUBCHEM., CID = 24470. Pulih dari: pubchem.NCBI.NLM.NIH.Gov
- Elsevier b.V. (2020). Nitrat perak. Scientedirect. Diperoleh dari: Scientedirect.com
- Universiti Iowa. (2020). Penggunaan nitrat perak dan ketoksikan. Pulih dari: ubat.Uiowa.Edu
- P.F. Lindley & p. Woodward. (1966). An X-Penyelidikan Ray Nitrat Perak: Struktur Nitrat Logam Unik. Jurnal Masyarakat Kimia A: Teoretis, fizikal, fizikal,.
- Lucy Bell Young. (2020). Apakah kegunaan perubatan nitrat perak. Bahan kimia reagen. Pulih dari: bahan kimia.co.UK

