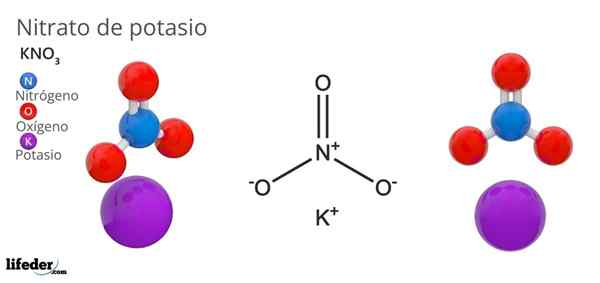
Potassium Nitrate (KNO3)
- 2174
- 498
- Delbert Dare
Apa itu kalium nitrat?
Dia Potassium nitrat Ia adalah garam ternary yang terdiri daripada kalium, logam alkali, dan oxoanion nitrat. Formula kimianya adalah kno3, Yang bermaksud untuk setiap k ion+, Tidak ada ion3-- Berinteraksi dengan ini. Oleh itu, ia adalah garam ionik dan merupakan salah satu nitrat alkali (lino3, Abang3, Rbno3...).
Kno3 Ia adalah ejen pengoksidaan yang kuat kerana kehadiran anion nitrat. Iaitu, ia berfungsi sebagai rizab ion nitrat pepejal, tidak seperti, tidak seperti garam yang sangat larut dalam air atau sangat hygroscopic. Banyak sifat dan penggunaan sebatian ini adalah disebabkan oleh anion nitrat, bukannya kation kalium.
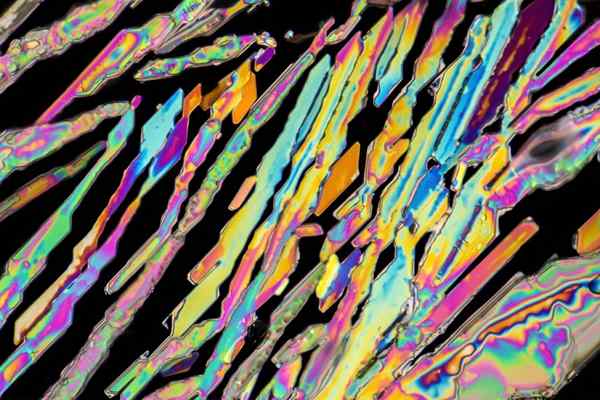 Potassium nitrat kristal
Potassium nitrat kristal Di bahagian atas beberapa kristal KNO digambarkan3 dengan bentuk jarum. Sumber semula jadi kno3 Adakah garam, dikenali sebagai nama Saltpeter Sama ada Belon, dalam Bahasa Inggeris. Unsur ini juga dikenali sebagai Potassa Nitrate atau Mineral Nitro.
Ia terletak di kawasan gersang atau padang pasir, serta efflorescence dinding gua. Satu lagi sumber penting KNO3 Ia adalah guano, kotoran haiwan yang mendiami persekitaran kering.
Struktur kimia kalium nitrat
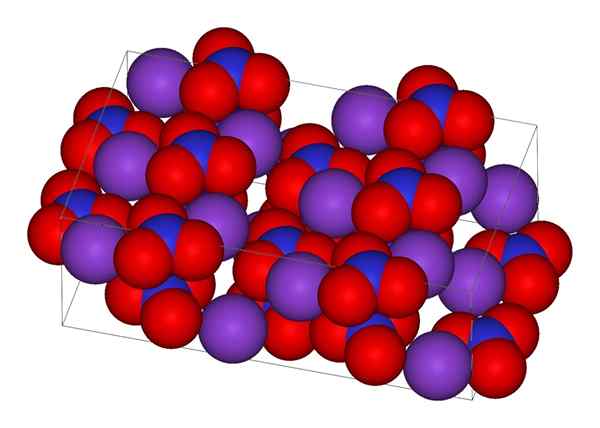 Struktur kristal kalium nitrat
Struktur kristal kalium nitrat Di bahagian atas, struktur kristal KNO diwakili3. Sfera ungu sesuai dengan k+, Walaupun merah dan biru adalah atom oksigen dan nitrogen. Struktur kristal adalah ortorrombik pada suhu bilik.
Nion Geometry no3- Ia adalah satah trigonal, dengan atom oksigen di simpang segitiga, dan atom nitrogen di pusatnya. Ia membentangkan beban formal positif dalam atom nitrogen, dan dua beban formal negatif dalam dua atom oksigen (1-2 = (-1)).
Boleh melayani anda: mikroskop sederhanaKedua -dua caj negatif ini tidak3- Mereka berpindah antara tiga atom oksigen, sentiasa mengekalkan beban positif dalam nitrogen. Sebagai akibat daripada di atas, k ion-+ kristal yang mereka elakkan berada di atas atau di bawah nitrogen anion tidak3-.
Malah, imej itu menunjukkan bagaimana k ion+ Mereka dikelilingi oleh atom oksigen, sfera merah. Kesimpulannya, interaksi ini bertanggungjawab untuk pengaturan kristal.
Fasa kristal lain
Pembolehubah seperti tekanan dan suhu dapat mengubah suai pengaturan ini dan menyebabkan fasa struktur yang berbeza untuk KNO3 (Fasa I, II dan III). Sebagai contoh, Fasa II adalah imej, manakala Fasa I (dengan struktur kristal trigonal) terbentuk apabila kristal dipanaskan sehingga 129 ºC.
Fasa III adalah pepejal peralihan yang diperoleh dari penyejukan fasa I, dan beberapa kajian telah menunjukkan bahawa ia mempamerkan beberapa sifat fizikal yang penting, seperti ferroelektrik. Dalam fasa ini, kristal membentuk lapisan kalium dan nitrat, mungkin sensitif terhadap penolakan elektrostatik antara ion.
Dalam lapisan fasa III, anion no3- Mereka kehilangan sedikit planariti mereka (lengkung segitiga sedikit) untuk membolehkan pengaturan ini, yang, sebelum sebarang gangguan mekanikal, menjadi struktur fasa II.
Penggunaan/aplikasi kalium nitrat
Garam sangat penting, kerana ia digunakan dalam pelbagai aktiviti manusia, yang nyata dalam industri, pertanian, makanan, dll. Kegunaan ini termasuk yang berikut:
- Pemeliharaan makanan, terutamanya daging. Walaupun disyaki bahawa ia campur tangan dalam pembentukan nitrosamine (agen karsinogenik) masih digunakan dalam charcuterie.
- Baja, kerana kalium nitrat menyediakan dua daripada tiga tumbuhan makronutrien: nitrogen dan kalium. Bersama -sama dengan fosforus, elemen ini diperlukan untuk pembangunan tumbuhan. Iaitu, ia adalah rizab penting dan terkawal dari nutrien ini.
- Mempercepat pembakaran, dapat menghasilkan letupan jika bahan mudah terbakar adalah luas atau jika ia dibahagikan halus (kawasan permukaan yang lebih besar, kereaktifan yang lebih besar). Di samping itu, ia adalah salah satu komponen utama serbuk mesiu.
- Memudahkan penyingkiran sentuhan pokok tinggi. Nitrat membekalkan nitrogen yang diperlukan untuk kulat untuk memusnahkan kayu tunggul.
- Ia campur tangan dalam pengurangan kepekaan pergigian melalui penggabungannya dalam gigi, yang meningkatkan perlindungan sensasi yang menyakitkan gigi yang dihasilkan oleh sejuk, panas, asid, gula -gula atau hubungan.
- Campur tangan sebagai hipotensor dalam peraturan tekanan darah pada manusia. Kesan ini akan diberikan atau saling berkaitan dengan perubahan dalam perkumuhan natrium. Dos yang disyorkan dalam rawatan ialah 40-80 mEq/hari kalium. Sehubungan ini, menunjukkan bahawa kalium nitrat akan mempunyai tindakan diuretik.
Sintesis
Sebilangan besar nitrat dihasilkan di lombong -lombong padang pasir di Chile. Ia boleh disintesis oleh beberapa reaksi:
NH4Tidak3 (ac) +koh (ac) => nh3 (Ac) +kno3 (Ac)+h2Atau (l)
Potassium nitrat juga meneutralkan asid nitrik dengan kalium hidroksida dalam reaksi yang sangat eksotermik.
Koh (ac) +hno3(conc) => kno3 (Ac) +h2Atau (l)
Pada skala perindustrian, kalium nitrat dihasilkan oleh reaksi anjakan berganda.
Abang3 (ac) +kcl (ac) => naCl (ac) +kno3 (Ac)
Sumber utama KCl adalah dari Silvina Mineral, dan bukan mineral lain seperti cannalite atau cainite, yang juga terdiri daripada magnesium ionik.
Sifat fizikal dan kimia
Potassium nitrat dalam keadaan pepejal dibentangkan sebagai putih atau dalam bentuk kristal struktur ortorombik pada suhu ambien, dan trigonal pada 129 ºC. Ia mempunyai berat molekul 101,1032 g/mol, ia adalah tandas dan mempunyai rasa ekar salin.
Ia adalah sebatian yang sangat larut di dalam air (316-320 g/liter air, pada 20 ° C), kerana sifat ioniknya dan kemudahan molekul air untuk menyelesaikan k ion k+.
Ketumpatannya ialah 2.1 g/cm3 pada 25 ºC. Ini bermaksud bahawa ia lebih kurang dua kali ganda daripada air.
Titik leburnya (334 ºC) dan mendidih (400 ºC) menunjukkan ikatan ionik antara k+ dan tidak3-. Walau bagaimanapun, ia rendah berbanding dengan garam lain, kerana tenaga reticular kristal lebih rendah untuk ion monovalen (iaitu, dengan beban ± 1), dan juga tidak mempunyai saiz yang serupa.
Boleh melayani anda: petunjuk pHIa terurai pada suhu yang dekat dengan titik mendidih (400 ° C) untuk menghasilkan kalium dan oksigen molekul:
Kno3(S) => kno2(s) + atau2(g)
Rujukan
- Pubchem. (2018). Potassium nitrat. Pulih dari pubchem.NCBI.NLM.Nik.Gov
- Cryst Act. (2009). Pertumbuhan dan penghalusan kristal tunggal fasa-III kalium nitrat, KNO3. B65, 659-663.
- Marni Wolfe. (3 Oktober 2017). Risiko Potassium Nitrate. Livestrong pulih.com
- Amethyst Galleries, Inc. (1995-2014). Niter mineral. Galeri pulih.com