Sifat nitrat, struktur, tatanama, latihan
- 1084
- 273
- Dallas Bernhard
The Nitrat Semuanya adalah sebatian yang mengandungi anion tidak3-, Ketika datang ke garam tak organik, atau kumpulan nitro, -ono2, Dalam kes derivatif organik. Dalam bukan organik, semua nitrat adalah garam logam atau ion ammonium, di mana interaksi elektrostatik m mendominasin+Tidak3-.
Contohnya, natrium nitrat3, Ia dibentuk oleh ion na+ dan tidak3-. Garam ini, bersama dengan kalium nitrat, kno3, adalah spesimen nitrat yang paling banyak. Nitrat Cari di Tanah, Dalam Tisu Tumbuhan, dan Di Atas Semua, Di Laut dan Deposit Salin Seperti Salitre, yang terletak di Chile.
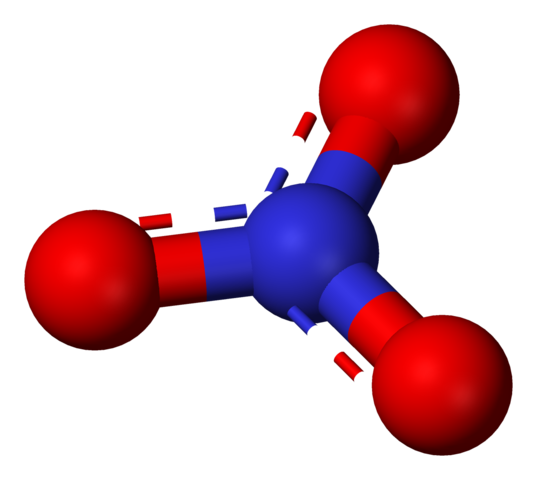
 Anion nitrat yang diwakili oleh model sfera dan bar. Sumber: Benjah-bmm27 / domain awam.
Anion nitrat yang diwakili oleh model sfera dan bar. Sumber: Benjah-bmm27 / domain awam. Istilah 'nitrat' segera merujuk kepada garam, baja dan bahan peledak. Mereka juga berkaitan dengan daging dan proses pengawetan mereka untuk menghalang pertumbuhan bakteria dan dengan itu melambatkan kemerosotan mereka. Nitrat juga sinonim untuk sayur -sayuran, kerana ia mengandungi jumlah garam yang tinggi.
Dia tidak3- (Imej Superior) adalah bentuk nitrogen yang paling teroksida, yang merupakan produk akhir dan boleh diasimilasikan kitaran biologinya. Nitrogen atmosfera menderita beberapa transformasi, sama ada oleh kerja sinaran elektrik atau melalui tindakan mikrob, untuk menjadi NH4+ dan tidak3-, kedua -dua larut dalam air dan diserap oleh tumbuhan.
Nitrat digunakan sebagai agen pengoksidaan, baja, bahan letupan dan ubat kardiologi. Penggunaan terakhir ini banyak berbeza dengan orang lain, kerana mereka memetabolisme atau berinteraksi dengan badan sedemikian rupa sehingga mereka meluaskan urat dan arteri; Dan oleh itu, terdapat peningkatan dan peningkatan aliran darah, melegakan sakit jantung.
[TOC]
Sifat nitrat
Neutraliti
Nitrat pada prinsip bahan neutral, kerana tidak3- Ia adalah asas asid nitrik yang konjugasi, HNO3, Asid yang kuat. Di dalam air, ia tidak ketara:
Tidak3- + H2Atau ⇌ hno3 + Oh-
Sebenarnya, boleh dikatakan bahawa hidrolisis ini tidak berlaku sama sekali, jumlah OH yang dihina-. Oleh itu, penyelesaian nitrat berair adalah neutral melainkan ada bahan terlarut yang lain.
Penampilan fizikal
Nitrat bukan organik terdiri daripada garam yang formula umumnya adalah m (tidak3)n, menjadi n Ia adalah valencia atau beban positif kation logam. Semua nitrat ini mempunyai kecerahan kristal dan mempunyai warna putih. Walau bagaimanapun, logam peralihan nitrat boleh berwarna.
Sebagai contoh, tembaga nitrat (II) atau nitrat cuprik, Cu (tidak3)2, Ia adalah pepejal kristal kebiruan. Sementara itu, nikel nitrat (ii), atau (tidak3)2, Ia adalah warna zamrud yang kukuh. Beberapa nitrat lain, seperti besi, warna samar -samar sekarang.
Sebaliknya, nitrat organik biasanya sangat sensitif dan pepejal letupan atau pepejal.
Ia boleh melayani anda: perkara hidup: konsep, ciri dan contohPenguraian terma
Nitrat logam sensitif terhadap suhu tinggi, kerana mereka mula rosak mengikut persamaan kimia berikut:
2m (no3)2(s) → 2mo (s)+4no2(g)+atau2(g)
Seperti yang diperhatikan, logam nitrat terurai ke dalam oksida, MO, dan nitrogen dan oksigen dioksida. Penguraian terma ini tidak berlaku pada suhu yang sama untuk semua nitrat; Ada yang menentang lebih banyak daripada yang lain.
Sebagai peraturan umum, semakin besar dan lebih kecil beban kation m adalah+, lebih besar akan menjadi suhu di mana nitrat mesti dipanaskan untuk rosak. Sebaliknya, ketika m+ Ia kecil atau mempunyai beban positif yang besar, nitrat terurai pada suhu yang lebih rendah, oleh itu lebih tidak stabil.
Contohnya, natrium nitrat3, Ia terurai pada suhu yang lebih rendah daripada barium nitrat, BA (tidak3)2, Nah, walaupun BA2+ mempunyai beban yang lebih besar daripada na+, Saiznya jauh lebih besar.
Ejen pengoksidaan
Dia tidak3- Ia adalah anion yang agak stabil. Walau bagaimanapun, atom nitrogennya sangat teroksida, dengan keadaan pengoksidaan +5 (n5+Sama ada32-), Jadi "dahaga" elektron. Atas sebab ini, nitrat adalah ejen pengoksidaan, yang akan berusaha merampas bahan -bahan elektron di sekelilingnya.
Ini adalah kekurangan elektron dalam atom nitrogen yang tidak3- Apa yang dilakukan Nano3 Dan kno3 Ejen pengoksidaan yang kuat, digunakan sebagai komponen serbuk. Menambah ciri ini fakta bahawa gas dilepaskan2 I2 Semasa mengurai, difahami mengapa ia adalah sebahagian daripada banyak bahan peledak.
Apabila nitrat memperoleh elektron atau mengurangkan, ia boleh diubah menjadi ammonia, NH3, atau dalam oksida nitrat, tidak, bergantung kepada reagen dan keadaan.
Kelarutan
Semua nitrat bukan organik, atau apa yang sama, logam dan ammonium nitrat, NH4Tidak3, Mereka adalah sebatian larut air. Ini kerana molekul air mempunyai pertalian yang kuat untuk tidak3-, Dan bahawa rangkaian kristal nitrat ini tidak stabil.
Struktur
Anion nitrat
 Struktur resonans nitrat. Sumber: Benjah-bmm27 / domain awam.
Struktur resonans nitrat. Sumber: Benjah-bmm27 / domain awam. Imej atas menunjukkan struktur resonans anion nitrat. Seperti yang dapat dilihat, dua caj negatif terletak di dua atom oksigen, yang dimusnahkan antara tiga atom oksigen. Oleh itu, masing -masing atau mempunyai beban -2/3, sementara nitrogen mempunyai beban +1.
Jadi, tidak3- Interaksi secara elektrostatik, atau bentuk koordinasi bentuk, melalui mana -mana tiga atom oksigen.
Pepejal
Semua nitrat bukan organik adalah garam dan ionik. Oleh itu, strukturnya adalah kristal, yang bermaksud bahawa ionnya, m+ dan tidak3-, Mereka diatur di angkasa terima kasih kepada interaksi elektrostatik mereka. Bergantung pada interaksi ini, kristal mereka akan membentangkan struktur yang berbeza.
Dapat melayani anda: apakah rombus keselamatan dan apa itu?Sebagai contoh, struktur kristal Nano3 Ia adalah trigonal atau rhomboédica, sementara kno3 Ia adalah ortorrombic.
Nitrat organik
Nitrat Organik diwakili dengan Formula Umum Rono2, di mana r adalah kumpulan alkil atau aromatik. Sebatian ini dicirikan oleh pautan R-aon mereka2, dan biasanya terdiri daripada derivatif nitrik polimer dan bahan organik lain.
Kompleks
Dia tidak3- Ia menyelaras dengan pusat logam untuk membentuk pautan m+-ATAU TIDAK2-, Menjadi interaksi yang berbeza dengan ionik. Kompleks ini pada dasarnya tidak bersifat organik. Nitrat juga boleh diselaraskan menggunakan dua atom oksigennya pada masa yang sama, m+-Sama ada2Tidak.
Nomenclature
Untuk melantik nitrat, perkataan 'nitrat' diikuti dengan nama kation atau kumpulan yang mengiringi ia dalam formula kimia masing -masing mesti ditulis terlebih dahulu. Valencia dari kation ditentukan dalam kurungan ketika memiliki lebih dari satu. Begitu juga, akhiran boleh digunakan -co dan -oy jika begitu disukai, mengikuti tatanama tradisional.
Sebagai contoh, pertimbangkan iman (tidak3)3. Namanya adalah besi nitrat (iii), kerana valensinya adalah +3, atau juga boleh dipanggil nitrat ferrik.
Peraturan ini juga memohon nitrat organik, dengan syarat struktur mereka mudah. Contohnya, CHO3ATAU TIDAK2 Ia dipanggil metil nitrat, kerana kumpulan -ch3 Ia menjadi kumpulan r yang mengiringi -ono2.
Latihan
Semulajadi
Nitrat terbentuk sebagai sebahagian daripada kitaran biologi nitrogen. Oleh sebab itu, tanah, lautan, dan beberapa arus air mempunyai sejumlah besar nitrat. Bergantung pada ion sekitarnya, garam nitrat yang berbeza akan dibentuk, menjadi nano3 Dan kno3 Yang paling biasa dan berlimpah.
Perindustrian
Nitrat dibentuk pada skala perindustrian dengan meneutralkan asid nitrik, sama ada dengan hidroksida logam, alkohol, polimer, dll. Sebagai contoh, kalsium nitrat, CA (tidak3)2, Ia boleh disediakan mengikut persamaan kimia berikut:
CA (oh)2 + 2hno3 → CA (Tidak3)2 + 2h2Sama ada
Begitu juga, beberapa bahan organik diserang oleh HNO3 Dalam keadaan tertentu untuk mempromosikan penggantian beberapa kumpulan mereka dengan -ono2. Inilah yang berlaku dengan tindak balas selulosa untuk berubah menjadi nitrat nitroselulosa atau selulosa, bahan polimer dan letupan.
Photocatalytic
Anion no3-, Dan oleh itu nitrat bukan organik, boleh dibentuk oleh tindakan photocatalytic sisa titanium oksida, paman2, Menggunakan sebagai bahan mentah tidak lebih daripada nitrogen dan oksigen udara. Kajian ini menganggap bahawa di mana terdapat kelebihan lelaki2, akan ada jumlah yang tidak diingini3-, yang mempengaruhi potensi air dan boleh merangkumi alga.
Boleh melayani anda: aldehidAplikasi
Menyembuhkan daging
 Sosej adalah salah satu daging yang diproses yang mengandungi lebih banyak nitrat. Sumber: Pxhere.
Sosej adalah salah satu daging yang diproses yang mengandungi lebih banyak nitrat. Sumber: Pxhere. Nitrat ditambah kepada beberapa daging, terutamanya sosej, untuk menghapuskan bakteria dan dengan itu melambatkan kemerosotan mereka. Mereka juga bertindak balas dengan protein mereka untuk memberi mereka warna yang lebih kemerahan. Masalah daging ini ialah, dengan memasaknya pada suhu tinggi, mereka menghasilkan nitrosoamines: sebatian yang dikaitkan dengan kanser kolon.
Reaksi ini sebahagiannya dielakkan jika terdapat vitamin hadir, seperti halnya sayur -sayuran, yang walaupun mereka kaya dengan nitrat, tidak dikaitkan dengan patologi karsinogenik.
Pertanian
Nitrat adalah sumber nitrogen yang larut. Oleh itu, ia berfungsi sebagai baja untuk menyumbang nitrogen ke tumbuh -tumbuhan, dan dengan itu, memihak kepada pertumbuhan mereka.
Ubat
Nitrat mempunyai fungsi khas dalam badan. Apabila mengasimilasikan tindakan enzimatik, ia dikurangkan kepada nitrik oksida, tidak. Molekul ini menduduki jumlah dan meluaskan urat dan arteri, yang membolehkan di sana menjadi aliran darah yang lebih besar. Oleh itu, nitrat digunakan sebagai ubat untuk memerangi patologi sistem peredaran darah.
Ironis dan ingin tahu, untuk tujuan ini nitrat organik seperti gliserilo, nitrogliserin, mononitrat isosorbid dan pentaerithritol tetranitrat telah digunakan, semua calon yang baik di dunia bahan letupan.
Bahan peledak
Nitrat digunakan dalam formulasi letupan, serbuk mesiu menjadi contoh yang paling simbolik. Menjadi ejen pengoksidaan, mereka memihak kepada pembakaran bahan, selain menyumbang kepada pengembangan yang mendadak jumlahnya disebabkan oleh pelepasan gas mereka selepas dekomposisi.
Contoh nitrat
Sepanjang bahagian sebelumnya lebih daripada satu contoh nitrat telah disebutkan. Akhirnya, beberapa yang lain akan disenaraikan bersama dengan formula dan nama masing -masing:
-Linen3: Lithium nitrat
-Rbno3: Rubidio nitrat
-Mg (no3)2: Magnesium nitrat
-Sc (no3)2: Scandio nitrate
-CR (tidak3)3: Nitrat krom (iii)
-Zn (no3)2: zink nitrat
-PB (tidak3)2: memimpin nitrat (ii)
-Agno3: nitrat perak
-Ch3Ch2ATAU TIDAK2: Etil nitrat
-Ch3(Ch2)4ATAU TIDAK2: Amilo Nitrate
Rujukan
- Shiver & Atkins. (2008). Kimia bukan organik. (Edisi Keempat). MC Graw Hill.
- Carey f. (2008). Kimia organik. (Edisi keenam). MC Graw Hill.
- Clark J. (5 Jun, 2019). Kestabilan haba nitrat dan karbonat. Kimia Librettexts. Pulih dari: chem.Libretxts.org
- Wikipedia. (2020). Nitrat. Diperoleh dari: dalam.Wikipedia.org
- Angela Dowden. (12 Mac, 2019). Kebenaran tentang nitrat dalam makanan anda. Diperolehi dari: BBC.com
- Elsevier b.V. (2020). Nitrat. Scientedirect. Diperoleh dari: Scientedirect.com
- Dr. Biji s. & Prof. Govindan v. (26 April 2017). Peranan nitrat organik dalam pengurusan perubatan optimum angina. Persatuan Kardiologi Eropah. Pulih dari: Escardio.org
- Yuan, s., Chen, j., Lin, z. et al. (2013). Pembentukan nitrat dari nitrogen atmosfera dan oksigen photocatalysed oleh titanium dioksida nano-sded. Nat Commun 4, 2249. doi.org/10.1038/NCOMMS3249
- « Asas Terapi Naratif Michael White, Prosedur, Teknik
- Nomenclature Epoxy, mendapatkan, aplikasi, contoh »

