Tiada sejarah logam, sifat, kumpulan, kegunaan

- 972
- 172
- Erick Krajcik
The tiada logam Mereka adalah sekumpulan elemen yang terletak di sebelah kanan jadual berkala, kecuali hidrogen yang terletak di Kumpulan 1 (AI), bersama -sama dengan logam alkali. Sekiranya anda ingin tahu apa yang mereka ada, anda perlu melihat sudut kanan atas blok P.
Atom bukan loget agak kecil dan lapisan elektronik luarannya mempunyai bilangan elektron yang tinggi. Antara unsur -unsur, pepejal, cecair dan gas yang tidak dapat dijumpai; Walaupun mereka kebanyakannya berada dalam keadaan gas, beberapa dari mereka memperkayakan suasana.
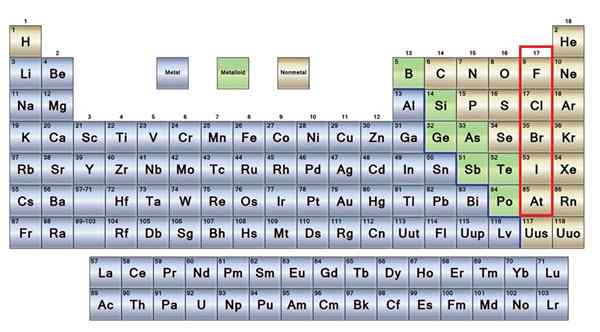 Unsur -unsur bukan logam berwarna coklat
Unsur -unsur bukan logam berwarna coklat Sebahagian besar daripada bukan logam hadir dalam semua makhluk hidup dalam bentuk sebatian dan makromolekul. Contohnya: Karbon, oksigen dan hidrogen hadir dalam semua protein, lipid, karbohidrat dan asid nukleat.
Fosforus hadir dalam semua asid nukleik dan dalam beberapa karbohidrat dan lipid. Sulfur terdapat di banyak protein. Nitrogen adalah sebahagian daripada semua asid dan protein nukleik.
Sebaliknya, bawah tanah, gas metana dan mentah minyak hampir terdiri daripada unsur -unsur bukan logam. Sebenarnya, hidrokarbon (karbon dan hidrogen) memberi gambaran tentang betapa banyaknya logam itu walaupun terdapat bilangan elemen yang lebih rendah dalam jadual berkala.
[TOC]
Sejarah
Dari zaman purba (3750 hingga.C.) Orang Mesir menggunakan arang batu untuk mengurangkan tembaga yang hadir di mineral mereka, seperti Corvelita dan Malachite.
Pada tahun 1669, jenama Hennin berjaya mengasingkan fosforus air kencing yang dikumpulkan. Henry Cavendish (1776) mencapai pengenalan hidrogen, walaupun beberapa penyelidik, termasuk Robert Boyle (1670), menghasilkan hidrogen dengan bertindak balas dengan asid kuat dengan logam.
Carl Scheele menghasilkan oksigen dengan memanaskan oksida merkuri dengan nitrat (1771). Curtois berjaya mengasingkan iodin, sambil cuba menyediakan garam dari rumpai laut (1811). Balard dan Gmelin mengasingkan Bome (1825).
Pada tahun 1868, Janssen dan Lockger Bebas. Moissan berjaya mengasingkan fluorida (1886).
Pada tahun 1894, Lord Rayleigh dan Ramsey menemui Argon dengan mengkaji sifat nitrogen. Ramsay dan Travers (1898) mengasingkan crypton, neon dan xenon argon cecair, oleh penyulingan kriogenik udara.
Sifat fizikal dan kimia
 Sulfur adalah salah satu elemen bukan -logam yang paling mewakili. Sumber: Ben Mills melalui Wikipedia.
Sulfur adalah salah satu elemen bukan -logam yang paling mewakili. Sumber: Ben Mills melalui Wikipedia. Fizikal
Beberapa sifat fizikal bukan logam adalah:
-Mereka mempunyai konduktansi elektrik yang rendah, kecuali karbon dalam bentuk grafit, yang merupakan konduktor elektrik yang baik.
Boleh melayani anda: Heptano (C7H16): Struktur, sifat dan kegunaan-Mereka boleh berlaku di bawah penampilan fizikal pepejal, cecair atau gas.
-Mereka mempunyai konduktansi haba yang rendah, kecuali karbon dalam bentuk berlian yang tidak berkelakuan seperti penebat haba.
-Mereka mempunyai sedikit kilauan, tidak seperti kecerahan logam logam.
-Pepejal bukan logam rapuh, jadi mereka tidak mulur atau mudah.
-Mereka mempunyai titik lebur dan mendidih yang rendah.
-Mereka boleh membentangkan struktur kristal yang berbeza. Oleh itu, fosforus, oksigen dan fluorida mempunyai struktur kristal padu; Hidrogen, karbon dan nitrogen, heksagon; dan sulfur, klorin, bromin dan iodin, ortorrombic.
Kimia
Bukan logam dicirikan dengan mempunyai tenaga pengionan yang tinggi dan nilai elektronegativiti yang tinggi. Fluorin, sebagai contoh, mempunyai elektronegativiti terbesar (3.98), sebagai elemen paling reaktif bukan logam.
Tetapi menghairankan, gas mulia helium (5.5) dan neon (4.84) mempunyai elektronegativiti terbesar. Walau bagaimanapun, mereka secara kimia tidak aktif kerana mempunyai lapisan elektronik luaran penuh.
Bukan logam membentuk sebatian ionik dengan logam, dan kovalen dengan bukan logam.
Unsur -unsur bukan logam membentuk molekul diatomik, dikaitkan dengan ikatan kovalen. Sementara itu, atom gas mulia berada dalam bentuk unit atom.
Mereka membentuk oksida asid yang bertindak balas dengan asid berasal dari air.
Kumpulan bukan logam dan elemen

Kumpulan 1
Ia dibentuk oleh hidrogen gas tidak berwarna dan tandas, dialotomik. Keadaan pengoksidaan +1. Ia mempunyai ketumpatan kurang daripada udara. Dalam keadaan pepejal ia membentangkan struktur kristal heksagon. Hidrogen adalah sedikit elemen reaktif.
Kumpulan 14
Karbon adalah satu -satunya yang tidak dimiliki oleh kumpulan ini. Karbon dalam bentuk grafit adalah pepejal yang berkilau, dengan struktur kristal heksagon. Mempunyai kekonduksian elektrik yang tinggi. Keadaan pengoksidaan yang paling biasa adalah +2 dan +4.
Kumpulan 15
Nitrogen
Gas tidak berwarna dan tandas. Ia adalah elemen reaktif sedikit dan sedikit lebih padat daripada udara. Keadaan pengoksidaan yang lebih biasa: -3 dan +5. Bentuk molekul diatom, n2.
Perlawanan
Pepejal, warnanya boleh putih, kuning atau hitam. Sedikit reaktif. Struktur kristal ortorrombik. Electronegativity 2,1. Keadaan pengoksidaan yang lebih biasa: -3 dan +5.
Kumpulan 16
Oksigen
Gas tanpa warna atau biru pucat, tandas. Umumnya tidak reaktif. Struktur kristal kubik. Ia adalah penebat dan ejen pengoksidaan yang kuat. Electronegativity 3.5. Keadaan pengoksidaan -2
Sulfur
Pepejal kuning terang, rapuh, sederhana reaktif. Struktur kristal ortorrombik. Bentuk ikatan kovalen. Electronegativity 2.5. Keadaan pengoksidaan yang lebih biasa: -2, +2, +4, dan +6.
Selenium
Pepejal kelabu hitam atau kemerah -merahan. Selenium kelabu menunjukkan kekonduksian elektrik sensitif ringan. Ia adalah pepejal yang lembut dan rapuh. Electronegativity 2.4. Negeri pengoksidaan: -2, +2, +4 dan +6.
Boleh melayani anda: kalium hidroksida: struktur, sifat, kegunaanKumpulan 17
Fluorin
Ia adalah gas kuning pucat, sangat beracun. Ia adalah elemen yang sangat reaktif. Ia dibentangkan sebagai molekul diatom, F2. Dalam keadaan pepejal mengkristal dalam bentuk padu. Electronegativity 3.98. Negeri pengoksidaan -1.
Klorin
Ia adalah gas kuning hijau. Mempersembahkan Molekul Diatom, CL2. Ia sangat reaktif. Dalam keadaan pepejal struktur kristal adalah ortorrombik. Electronegativity 3.0. Negeri Pengoksidaan: - 1, +1, +3, +5, +7.
Bromin
Ia adalah cecair merah kafe. Electronegativity 2.8. Keadaan pengoksidaan -1, +1, +3, +5 dan +7.
Iodin
Ia adalah pepejal hitam yang apabila ia tidak memancarkan wap ungu. Struktur kristal ortorrombik. Iodida logam adalah ionik. Electronegativity 2.5. Negeri Pengoksidaan: -1, +1, +3, +5, y +7.
Astato
Ia adalah pepejal hitam. Struktur kristal padu berpusat di muka. Electronegativity 2,2. Ia adalah ejen pengoksidaan yang lemah.
Kumpulan 18
Helium
Mempunyai kekonduksian terma yang tinggi. Electronegativity 5.5. Ia tidak aktif secara kimia dan tidak mudah terbakar. Ketumpatan rendah dan ketidakstabilan yang tinggi.
Neon
Kapasiti penyejukan tinggi dalam keadaan cair. Electronegativity 4.84. Ia adalah reaktif gas yang mulia.
Argon
Ia lebih padat daripada udara. Kimia tidak aktif. Electronegativity 3.2.
Krypton
Electronegativity 2.94. Boleh bertindak balas dengan fluorida untuk membentuk crypton difluoride (KRF2).
Xenon
Melintasi penghalang otak darah. Menanggapi cahaya menghasilkan arus elektrik. Electronegativity 2,2. Bentuk kompleks dengan fluorin, emas dan oksigen.
Radon
Ia adalah elemen radioaktif. Electronegativity 2.06. Bentuk sebatian dengan fluorida (RNF2) dan dengan oksigen (RNO3).
Aplikasi
Hidrogen

Ia digunakan dalam pendorong roket dan sebagai bahan bakar dalam enjin kereta yang menggunakan hidrogen. Ia digunakan dalam sintesis ammonia (NH3) dan dalam penghidrogenan lemak.
Karbon
Grafit digunakan dalam pembuatan pensil dan gentian tinggi yang digunakan dalam penjelasan artikel sukan. Berlian digunakan sebagai permata yang bernilai tinggi dan dalam latihan penggerudian sebagai kasar. Karbon dioksida digunakan dalam penjelasan minuman ringan.
Nitrogen
Ia digunakan dalam pengeluaran ammonia, asid nitrik dan urea. Nitrogen adalah elemen penting untuk tumbuh -tumbuhan dan digunakan dalam pembuatan baja.
Perlawanan
Fosforus putih digunakan sebagai raticide, insektisida dan dalam industri piroteknik. Fosforus merah digunakan dalam pembuatan perlawanan. Sebatiannya juga digunakan dalam penjelasan baja.
Oksigen
Oksigen digunakan dalam penjelasan keluli, plastik dan tekstil. Ia juga digunakan dalam roket, terapi oksigen dan bantuan pernafasan dalam pesawat, kapal selam dan penerbangan ruang angkasa.
Boleh melayani anda: Erbio: struktur, sifat, mendapatkan, menggunakanSulfur
Ia digunakan sebagai bahan mentah untuk pengeluaran asid sulfurik, serbuk mesiu dan dalam pembubaran karet. Sulfit digunakan untuk peluntur kertas dan fungisida.
Selenium
Ia digunakan untuk memberikan warna merah merah ke kaca. Ia juga digunakan untuk meneutralkan nuansa kehijauan yang dihasilkan oleh pencemaran kaca dengan sebatian besi. Ia digunakan dalam sel fotoelektrik dengan aplikasi di pintu dan lif.
Fluorin

Ia ditambah kepada krim pergigian untuk mengelakkan karies. Fluorida hidrogen digunakan sebagai bahan mentah untuk Teflon. Fluoror monoatomik digunakan dalam pembuatan semikonduktor.
Klorin
Ia digunakan dalam pengklorinan metalurgi dan hidrokarbon ekstraktif untuk pembuatan pelbagai produk seperti PVC. Klorin digunakan dalam pemutihan pulpa kayu dan tekstil. Ia juga digunakan sebagai pembasmi kuman air.
Bromin
Ia digunakan dalam penyediaan bromida perak untuk lensa sensitif cahaya dan dalam filem fotografi ia juga digunakan dalam penjelasan natrium bromida dan dibromethane, komponen anti -domain petrol.
Iodin
Potassium Iodide (Ki) ditambah untuk mengelakkan goiter tiroid. Tincture iodin digunakan sebagai antiseptik dan germicide. Iodin adalah sebahagian daripada hormon tiroid.
Helium
Ia digunakan dalam mengisi belon udara panas dan dicampur dengan oksigen untuk pernafasan air dalam. Ia digunakan untuk kimpalan dalam suasana lengai, dan membantu mengekalkan suhu penyelidikan yang sangat rendah.
Neon
Dalam tiub kaca yang menyala untuk tindakan elektrik (lampu merah neon).
Argon
Ia digunakan untuk mewujudkan suasana untuk kimpalan dan dalam pengisian lampu sorot incandescence.
Xenon
Campuran Xenon dan Crypton digunakan dalam pengeluaran kilat keamatan yang hebat dalam pameran fotografi pendek.
Radon
Ia digunakan dalam rawatan tumor kanser oleh radioterapi.
Rujukan
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (8th ed.). Pembelajaran Cengage.
- Shiver & Atkins. (2008). Kimia bukan organik. (Edisi Keempat). MC Graw Hill.
- Mathews, c. K., Van holde, k. Dan. Dan ahern, k. G. (2002). Biokimia. Edisi ketiga. Edit. Pearson-Addison Wesley
- Helmestine, Anne Marie, Ph.D. (6 Oktober 2019). Apakah sifat bukan logam? Pulih dari: Thoughtco.com
- Wikipedia. (2019). Nonmetal. Diperoleh dari: dalam.Wikipedia.org
- Editor enyclopaedia Britannica. (5 April 2016). Nonmetal. Encyclopædia Britannica. Pulih dari: Britannica.com
- Jose m. Gavira Vallejo. (27 Januari 2016). Apakah pnicogens? Dan icosogenos, crystallogens, calcogens .. ? Diperolehi dari: Triplenlace.com

