Jenis Proses Adiabatik, Contoh, Latihan Diselesaikan
- 2969
- 818
- Ms. Santos Fritsch
A Proses adiabatik Ia adalah di mana tidak ada pertukaran haba antara sistem dan persekitarannya, sama ada kerana ia berlaku dalam medium penebat, atau kerana ia berlalu dengan cepat. Ini bermakna bahawa di persekitaran sistem, ini adalah, bahagian alam semesta yang sedang dikaji, perubahan suhu tidak boleh dirasakan, tetapi hanya berfungsi.
Ini adalah salah satu proses asas termodinamik. Tidak seperti proses lain (isocoric, isobaric dan isothermal), tidak ada pembolehubah fizikalnya yang tetap tetap; iaitu magnitud tekanan, kelantangan, suhu dan perubahan entropi apabila proses adiabatik berkembang.
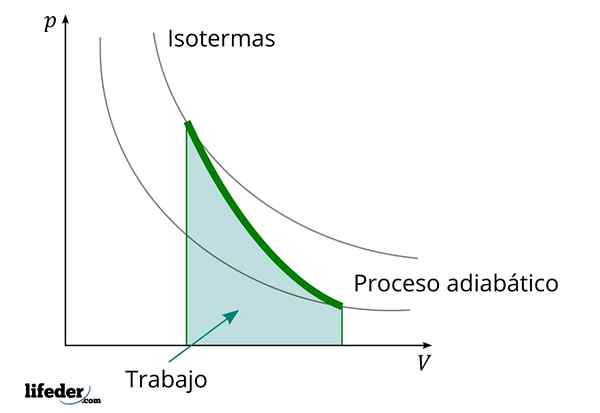
 Semasa proses adiabatik di mana jumlahnya meningkat, tenaga dalaman bahan yang dikurangkan oleh kerja
Semasa proses adiabatik di mana jumlahnya meningkat, tenaga dalaman bahan yang dikurangkan oleh kerja Satu lagi ciri penting proses adiabatik ialah mereka menjalankan atau mengambil kerja secara proporsional dengan variasi tenaga dalaman sistem mereka; Dalam kes ini, daripada molekulnya dalam fasa gas. Ini dapat ditunjukkan terima kasih kepada undang -undang termodinamik pertama.
Dalam kehidupan seharian jenis proses ini meliputi di atas semua ke fenomena geofizik dan, sedikit sebanyak, fungsi piston di enjin diesel. Pemindahan haba sering dicegah dengan menggunakan medium penebat, tetapi ia adalah kelajuan proses ini yang membolehkan perkembangan sebenar mereka.
[TOC]
Proses adiabatik yang boleh diterbalikkan dan tidak dapat dipulihkan
Boleh diterbalikkan
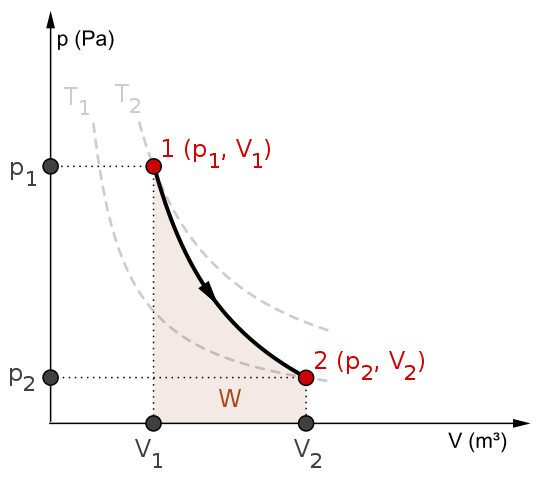 Rajah p-v dan kerja w untuk proses adiabatik. Sumber: Mikerun/CC BY-SA (https: // creativeCommons.Org/lesen/by-sa/4.0)
Rajah p-v dan kerja w untuk proses adiabatik. Sumber: Mikerun/CC BY-SA (https: // creativeCommons.Org/lesen/by-sa/4.0) Proses adiabatik boleh diterbalikkan atau tidak dapat dipulihkan. Walau bagaimanapun, bekas hanya wujud sebagai alat teoritis untuk mengkaji yang terakhir. Oleh itu, proses adiabatik yang boleh diterbalikkan melibatkan gas yang ideal, dan kekurangan geseran dan sebarang kemungkinan lain yang menyebabkan pemindahan haba antara sistem dan persekitarannya.
Pertimbangkan, sebagai contoh, rajah P-V untuk proses adiabatik yang boleh diterbalikkan dari atas. T1 dan t2 sesuai dengan dua isoterms, di mana tekanan P dan jumlahnya V sistem berbeza -beza.
Antara negeri (p1, V1) Dan p2, V2) Pengembangan adiabatik yang boleh diterbalikkan dilakukan, kerana kita bergerak dari volum v1 kepada satu v2, lebih besar, mengikuti arah anak panah.
Dengan berbuat demikian, sistem itu menyejukkan, tetapi tanpa mematuhi tingkah laku isotherms. Kawasan di bawah lengkung sepadan dengan kerja w, yang nilainya positif kerana ia adalah pengembangan.
Dalam proses ini entropi tetap malar dan, oleh itu, dikatakan bahawa ia adalah isontropik. Pemprosesan matematik kebolehulangan ini menghasilkan satu set persamaan yang mungkin untuk menilai sistem lain.
Boleh melayani anda: Sel elektrolisisTidak dapat dipulihkan
Proses adiabatik yang tidak dapat dipulihkan, tidak seperti yang boleh diterbalikkan, tidak grafik dalam gambar rajah P-V dengan garis yang berterusan tetapi bertitik, kerana hanya keadaan akhir dan awal yang mempunyai pembolehubah mereka (p, v dan t) dengan baik ditakrifkan. Proses ini melibatkan gas sebenar, jadi persamaan gas ideal dan derivasi mereka tidak boleh digunakan secara langsung.
Mereka lulus dengan cepat, menghalang pemindahan haba antara sistem dan persekitarannya. Juga, di dalamnya entropi meningkat, seperti yang dinyatakan dalam undang -undang termodinamik kedua.
Contoh proses adiabatik
 Kapasiti penebat, seperti yang dibentangkan oleh thermos, adalah salah satu faktor utama untuk proses untuk membangunkan secara adiabatik
Kapasiti penebat, seperti yang dibentangkan oleh thermos, adalah salah satu faktor utama untuk proses untuk membangunkan secara adiabatik Beberapa contoh proses adiabatik akan disebutkan di bawah.
Pengembangan dan pemahaman
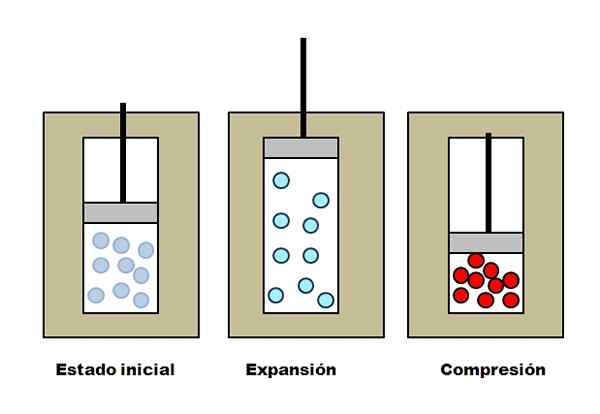 Pengembangan dan pemahaman adiabatik. Sumber: Gabriel Bolívar.
Pengembangan dan pemahaman adiabatik. Sumber: Gabriel Bolívar. Katakan tiga jaket penebat yang mengandungi petak penuh dengan gas. Dalam keadaan awal, omboh tidak mempunyai tekanan ke atas gas. Kemudian, omboh dibenarkan meningkat, yang meningkatkan jumlah di mana molekul gas boleh bergerak, menyebabkan penurunan tenaga dalamannya; Dan oleh itu, penurunan suhu.
Sebaliknya berlaku dengan pemampatan adiabatik: omboh melakukan kerja pada gas, mengurangkan jumlah yang dapat ditempati molekulnya. Tenaga Dalaman Kali ini meningkat, yang juga menunjukkan peningkatan suhu, yang haba tidak dapat menyebarkan ke arah persekitaran kerana jaket penebat.
Pendakian Magma
Saluran di mana magma naik di dalam gunung berapi sebagai medium penebat, yang menghalang pemindahan haba antara magma dan suasana.
Penyebaran bunyi
Gas terganggu dan berkembang mengikut gelombang bunyi tanpa menyejukkan atau panas udara yang mengelilinginya.
Kesan foehn
Kesan Foehn adalah contoh proses adiabatik dalam bidang geofizik. Jisim udara naik ke arah bahagian atas gunung di mana mereka mengalami tekanan yang kurang, jadi molekul mereka berkembang dan sejuk, menimbulkan pembentukan awan.
Walau bagaimanapun, mereka hampir tidak turun di seberang gunung, tekanan meningkat dan, oleh itu, molekul dimampatkan dan menaikkan suhu mereka, menyebabkan awan hilang.
Boleh melayani anda: chlorobenzene (c6h5cl)Dalam video berikut fenomena ini dapat dihargai:
Latihan yang diselesaikan
Akhirnya, beberapa latihan akan diselesaikan. Penting untuk mempunyai persamaan berikut:
Δu = q - w (undang -undang termodinamik pertama)
Tetapi tidak mempunyai pemindahan haba, q = 0 y:
Δu = - w (1)
Ini adalah: jika kerja w positif, Δu negatif, dan sebaliknya. Sebaliknya, kita juga mempunyai:
W = -nCVΔt (2)
Bahawa selepas menggunakan persamaan gas yang ideal (PV = nRt), dan menggantikan dan menyelesaikan t2 dan t1 kita akan mempunyai:
W = (cV/R) (P1V1 - P2V2) (3)
Menjadi nilai r sama dengan 0.082 l · atm/mol · k atau 8.314 J/mol · k
Dalam proses adiabatik, penting untuk mengetahui hubungan cP/CV dikenali sebagai γ:
γ = cP/CV (4)
Yang membolehkan mewujudkan hubungan T-V dan P-V:
T1V1γ-1 = T2V2γ-1 (5)
P1V1γ = P2V2γ (6)
Dan juga, anggaran pemanasan cP dan cV Mereka berbeza -beza bergantung kepada sama ada gas adalah monoatomik, diatomik, dan lain -lain.
Latihan 1
Gas melakukan 600 j kerja melalui petak terpencil. Apakah perubahan tenaga dalamannya? Adakah suhu menurun atau meningkat? Dan memandangkan ia adalah gas monoatomik, juga mengira γ.
Data:
W = +600j
Δu = ¿?
γ =?
Kerja w adalah positif kerana gas tidak berfungsi di persekitaran. Berada di dalam petak terpencil, q = 0, dan oleh itu kita akan mempunyai persamaan (1):
Δu = - w
Iaitu, ΔU adalah sama dengan:
Δu = - (+600j)
= -600J
Yang bermaksud bahawa tenaga dalaman gas menurun 600 j. Sekiranya ΔU berkurangan, begitu pula suhu, jadi gas sejuk akibat daripada melakukan kerja.
Kerana gas ini monoatomik,
CV = 3/2 r
CP = 5/2 r
Dan menjadi
γ = cP/CV
= (5/2 R)/(3/2 R)
= 5/3 atau 1.66
Latihan 2
Dalam bekas 7 tahi lalat o2 Mereka dimampatkan dari jumlah 15 liter hingga 9 liter. Mengetahui bahawa suhu awal adalah 300 k, hitung: kerja yang dilakukan pada gas.
Data:
n = 7 mol atau2
T1 = 300 k
V1 = 15 l
V2 = 9 l
W = ¿?
Ini adalah pemahaman adiabatik yang tidak dapat dipulihkan. Kami mempunyai dua persamaan untuk menyelesaikan W:
W = -nCVΔt (2)
W = (cV/R) (P1V1 - P2V2) (3)
Tekanan dapat mengira mereka, tetapi untuk menjimatkan masa, lebih baik untuk meneruskan persamaan pertama:
Boleh melayani anda: air sulingW = -nCVΔt
= -nCV (T2-T1)
Kita perlukan cV dan t2 Untuk menentukan w. Oksigen, menjadi gas diatomik, mempunyai cV sama dengan 5/2 r:
CV (Sama ada2) = 5/2 r
= 5/2 (8.314 J/mol · k)
= 20.785 J/mol · k
Kita perlu mengira t2. Kami beralih kepada persamaan (5):
T1V1γ-1 = T2V2γ-1
Tetapi sebelum menggunakannya, anda perlu menentukan c pertamaP dan γ:
CP (Sama ada2) = 7/2 r
= 7/2 (8.314 J/mol · k)
= 29.099 J/mol · k
Menjadi γ sama dengan:
γ = cP/CV
= (29.099 J / mol · k) / 20.785 J/mol · k
= 1.4
Jadi, kita dapat membersihkannya2 Dari Persamaan (5):
T1V1γ-1 = T2V2γ-1
T2 = (T1V1γ-1) / (V2γ-1)
= [(300K) (15L)1.4-1] / (9L)1.4-1
= 368.01 k
Dan akhirnya kita menyelesaikannya:
W = -nCVΔt
= -(7 mol o2) (dua puluh.785 J/mol · k) (368.01 K - 300 K)
= -9895.11 J o -9.895 kJ
Latihan 3
Bekas neon memperluaskan adiabatik dan pada mulanya pada suhu bilik (t = 298k) dari 12 l hingga 14 l. Mengetahui bahawa tekanan awalnya ialah 3 atm, apa yang akan dilakukan oleh gas?
Data:
T1 = 298 k
V1 = 12 l
V2 = 14 l
P1 = 3 atm
W = ¿?
Persamaan (3) membolehkan kita menentukan W dengan nilai tekanan:
W = (cV/R) (P1V1 - P2V2)
Tetapi kita hilang cV Dan p2.
Tekanan akhir boleh dikira dengan persamaan (6):
P1V1γ = P2V2γ
Menjadi γ sama dengan cP/CV. Oleh kerana neon adalah gas monoatomik, kami mempunyai nilai cP dan cV Masing -masing 5/2r dan 3/2r. Kami mengira kemudian γ:
γ = cP/CV
= (5/2R)/(3/2R)
= 5/3 atau 1.66
Kami membersihkan p2 Dari Persamaan (6):
P2 = (Ms1V1γ) / V2γ
= [(3 atm) (12 l)5/3] / (14 l)5/3
= 1.40 atm
Dan kerja akan sama dengan:
W = (cV/R) (P1V1 - P2V2)
= (3/2) [(3 atm) (12 l) - (1.40 atm) (14 l)] (101300 PA/1 atm) (0.001 m3/L) (kJ/1000 j)
= 2.49 kJ
Faktor penukaran digunakan untuk menukar l · atm a pa · m3, yang bersamaan dengan 1 j. Gas neon berkembang, jadi tekanannya berkurangan dan, ketika melakukan kerja di persekitaran, ini positif. Juga, tenaga dalamannya ΔU berkurangan, serta suhunya, penyejukan dalam proses pengembangan.
Rujukan
- Walter J. Moore. (1963). Kimia Fizikal. Dalam kinetik kimia. Edisi keempat, Longmans.
- Iran. Levine. (2009). Prinsip Fizikokimia. Edisi keenam. MC Graw Hill.
- Wikipedia. (2020). Proses adiabatik. Diperoleh dari: dalam.Wikipedia.org
- Jones, Andrew Zimmerman. (18 Ogos 2020). Themodynamics: Proses Adiabatik. Pulih dari: Thoughtco.com
- Devoe Howard & Neils Tom. (9 Ogos 2020). Perubahan adiabatik. Kimia Librettexts. Pulih dari: chem.Libretxts.org

