Jenis tindak balas sintesis, faktor, contoh
- 1894
- 106
- Horace Gulgowski
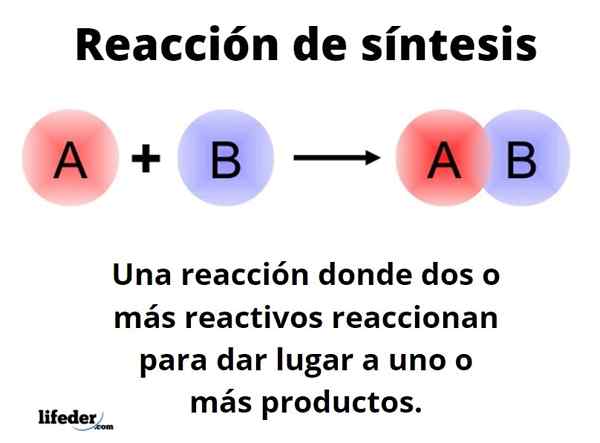
The Tindak balas sintesis Ia adalah satu di mana dua atau lebih reagen bertindak balas untuk dapat berasal, secara kuantitatif, satu atau lebih produk, sama ada di peringkat makmal atau perindustrian. Ini adalah salah satu tindak balas kimia yang paling asas, dan jenis dan reka bentuknya bersempadan hampir tak terhingga.
Cara generik boleh diwakili dengan bentuk: a+b → c. Dalam tindak balas sintesis yang mudah, reagen bertindak balas dengan reagen b yang lain, untuk menghasilkan produk C. Dikatakan bahawa ia terdiri daripada satu langkah. Walau bagaimanapun, ia mungkin berlaku untuk bertindak balas terlebih dahulu dengan E, diikuti oleh F, dan akhirnya dengan G (reagen lain), untuk berubah menjadi produk C; iaitu, tindak balas yang sama berlaku dalam pelbagai langkah.

Tidak kira satu langkah atau banyak, semua tindak balas sintesis didasarkan pada keberkesanan (termodinamik dan kinetik) yang reagen bertindak balas untuk berubah menjadi produk, serta prestasi eksperimen. Dikehendaki bahawa tindak balas sintesis berjaya dan menghasilkan sebanyak mungkin produk.
[TOC]
Jenis tindak balas sintesis
Sederhana atau berganda
Reaksi sintesis tidak sepenuhnya mudah diklasifikasikan. Ia boleh menjadi isu yang berkaitan dengan kriteria kimia. Kerana? Katakan reaksi berganda yang dikomentari di atas:
A + E → P1
P1 + F → p2
P2 + G → c
Menjadi p1 Dan p2 perantara yang tidak menarik. Reaksi sintesis produk atau kompaun C, bermula dari A sebagai reagen utama (mengehadkan atau mengehadkan reagen), adalah pelbagai atau kompleks, kerana ia berlaku dalam beberapa langkah, di mana reagen lain mengambil bahagian: E, F dan G.
Setiap tiga reaksi sebelumnya boleh terdiri dan jenis tindak balas kimia dalam diri mereka. Iaitu, tindak balas sintesis boleh daripada apa -apa jenis tindak balas kimia lain (anjakan berganda, redoks, pembakaran, peneutralan, nitrasi, penggantian, dll.), selagi produk berasal dan mempunyai prestasi eksperimen yang berkaitan.
Jadi:
A + E → P1
Ia dapat dilihat sebagai tindak balas sintesis yang mudah untuk produk p1, tanpa mengira jenis reaksi yang. Dan juga:
P1 + F → p2
Ia adalah satu lagi tindak balas sintesis mudah untuk produk p2.
Bukan organik atau organik
Reaksi sintesis boleh semestinya berkaitan dengan sifat tindak balas dan mekanisme molekulnya. Walau bagaimanapun, ini boleh dibahagikan mengikut sifat kimia reagen dan produk.
Boleh melayani anda: natrium asetat: struktur, sifat, sintesis, kegunaanSebagai contoh, jika reagen adalah bahan bukan organik, maka kita bercakap tentang sintesis bukan organik; Walaupun jika mereka adalah bahan organik, kami akan bercakap mengenai sintesis organik.
Bidang sintesis organik adalah kolosal, kerana ia meliputi produksi ubat, pewarna, plastik, racun serangga, pelekat, minyak wangi, pengawet, antara beribu -ribu produk lain.
Faktor yang terlibat dalam tindak balas sintesis
Faktor yang terlibat dalam tindak balas sintesis adalah semua parameter atau pembolehubah, fizikal dan kimia, yang secara langsung mempengaruhi prestasi tindak balas dan kualiti produk yang berasal. Sebahagian daripada mereka adalah yang berikut:
Suhu
Suhu adalah penting dalam sebarang tindak balas sintesis. Bergantung pada termodinamik anda, mungkin mudah untuk kekal rendah atau tinggi. Begitu juga, terdapat julat suhu di mana tindak balas lateral yang tidak diingini mungkin, jadi penting untuk mengawalnya dan mengesahkannya pada setiap masa.
Masa
Masa juga penting dalam tindak balas sintesis, kerana ia mesti memastikan bahawa ia sudah cukup untuk menjamin penubuhan keseimbangan. Selepas masa tertentu, lebih banyak produk akan berhenti diperoleh, dan ketika itu ia memutuskan untuk menghentikan sintesis sepenuhnya.
Konsentrasi dan kualiti reagen
Semakin banyak tertumpu reagen, semakin cepat reaksi. Walau bagaimanapun, adalah penting untuk jelas mengenai perkadaran kepekatannya, serta magnitudnya, kerana perubahan minimum akan mempengaruhi prestasi akhir.
Sebaliknya, reagen mestilah sebaik mungkin, jika tidak, kepekatan yang salah akan diandaikan; Atau lebih teruk, produk akan tercemar, atau tindak balas yang tidak diingini akan berlaku.
Agitasi
Cara di mana medium tindak balas diaduk akan mempengaruhi rapides reaksi sintesis.
Tekanan
Tekanan, seperti kepekatan, memainkan peranan penting, terutamanya apabila reagen adalah spesies soda atau bahan. Semakin besar tekanan, semakin besar pertembungan atau interaksi antara reagen dan, oleh itu, akan lebih cenderung untuk bertindak balas.
Ph
PH (asid atau asas) secara langsung mempengaruhi mekanisme tindak balas, jadi ia merupakan faktor utama dalam menentukan produk mana yang akan diperoleh pada akhir sintesis.
Boleh melayani anda: titik mendidih: konsep, pengiraan dan contohPemangkin
Pemangkin adalah bahan yang mempercepat tindak balas kimia tetapi tanpa dimakan semasa proses. Terdapat sintesis bahawa tanpa campur tangan anda, mustahil.
Contoh tindak balas sintesis
Seterusnya, dan akhirnya, persamaan kimia untuk tindak balas sintesis beberapa sebatian akan disebutkan.
Garam meja (natrium klorida)
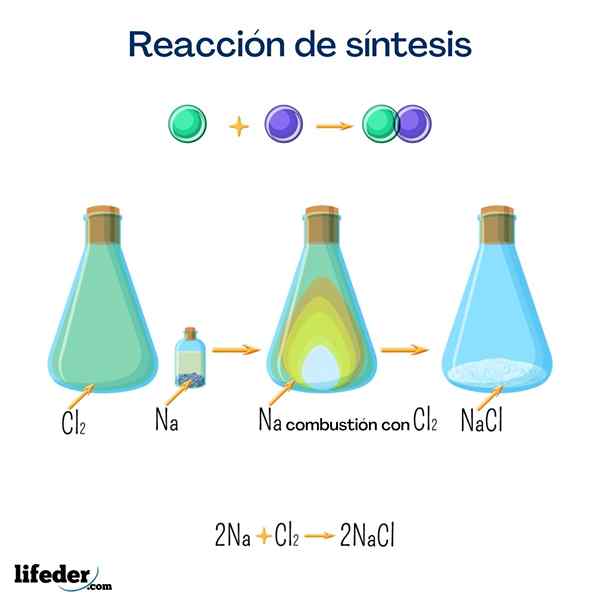
Garam ini adalah salah satu yang paling terkenal oleh semua untuk kegunaan domestik yang hebat. Ia diperoleh dari natrium dan klorin, dan walaupun dapat diperoleh dengan reaksi berikut, sangat mudah untuk menemuinya secara semula jadi.
2 Na+Cl 2 → 2 NaClGlukosa
Ini adalah salah satu tindak balas yang paling penting untuk kehidupan seperti yang kita ketahui. Tumbuhan menggunakan karbon dioksida dan persekitaran persekitaran dengan cahaya matahari untuk menghasilkan glukosa dan oksigen.
Reaksi dengan cara yang sangat umum dapat dilihat di bawah, tetapi penting untuk memahami bahawa di belakangnya terdapat beberapa reaksi dan mekanisme untuk ini mungkin.
6CO2 + 6H2O → C6H12O6 + O2
Saccharose
Reaksi sintesis ini berlaku dalam organisma hidup dan diberikan apabila polimerisasi glukosa dengan fruktosa. Oleh kerana struktur mereka, kedua -dua molekul ini berinteraksi dan hasil akhir adalah sukrosa dan air, seperti yang dapat dilihat dalam persamaan berikut:
C6H12O6 + C6H12O6 → C12H22O11 + H2O
Ammonia
3 jam2(g) + n2(g) → 2 nh3(g)
Reagen h2 dan n2 Mereka adalah gas. Tekanan mesti tinggi untuk molekul anda untuk bertindak balas dan berasal dari ammonia, NH3. Ini adalah salah satu tindak balas sintesis yang paling penting mengenai kimia perindustrian.
Air
2 jam2(g) + atau2(g) → 2 jam2O (g)
H2 I2 bertindak balas secara exothermically untuk menghasilkan wap air. Jumlah tenaga yang dikeluarkan adalah sedemikian rupa sehingga hidrogen adalah salah satu bahan api yang paling menjanjikan dalam aplikasi aeroangkasa.
Alkohol
C2H4(g) + h2Atau (l) → cho3Ch2Oh (l)
Ethanol dikenali sebagai alkohol, hanya menjadi salah satu daripada banyak alkohol yang wujud. Reaksi sintesisnya terdiri daripada penghidratan etilena, c2H4 atau h2C = ch2, di mana molekul air ditambah kepada ikatan berganda.
Asid sulfurik
Asid sulfurik mempunyai beberapa laluan sintetik yang cekap. Walau bagaimanapun, yang paling mudah terdiri daripada beberapa langkah:
Boleh melayani anda: carboxymethylcelluloseS (s) +o2(g) → begitu2(g)
2 Jadi2(g)+atau2(g) ⇌ 2 Jadi3(g)
SW3(g)+h2Atau (l) → h2SW4(g)
H2SW4(g) → h2SW4(L)
Sulfur terbakar dengan oksigen yang berlebihan untuk berubah menjadi SO2, Dan kemudian di SO3. Maka SO3 terhidrasi untuk menghasilkan hap2SW4, yang akhirnya terkondensasi dalam h2SW4 cecair. Sintesis ini sangat penting, dengan sendirinya menunjukkan betapa kuatnya.
Methanol
Co (g) + 2 jam2(g) → ch3Oh (l)
Gas Co dan H2 bertindak balas dan memeluk pemangkin logam untuk menimbulkan metanol, alkohol yang paling mudah dari semua.
Magnesium sulfat
Ia boleh berlaku dari tindak balas yang sangat mudah yang terdiri daripada asid magnesium dan sulfurik. Sangat sukar untuk menemuinya tanpa air.
Mg + H2SO4 → H2 + MgSO4
Karbon dioksida
Ia berlaku secara semulajadi dalam beberapa proses, apabila karbon dioksida dihasilkan dengan molekul karbon dioksida.
Ia terdapat dalam proses semula jadi seperti bernafas, sebagai reagen dalam fotosintesis dan berlaku dengan mudah dalam reaksi pembakaran.
C +O2 → CO2
Asid hidroklorik
Asid hidroklorik digunakan secara meluas sebagai asid murah dan sebagai ejen reaktif untuk sintesis sebatian lain.
Cl2+h2 → 2hcl
Kalsium karbonat
Ia dikenali sebagai ejen yang sangat banyak, terutamanya di dalam batu, mineral dan cengkerang di laut. Reaksinya didasarkan pada interaksi kalsium oksida dengan karbon dioksida.
CAO +CO2 → CACO3
Rujukan
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (8th ed.). Pembelajaran Cengage.
- Shiver & Atkins. (2008). Kimia bukan organik. (Edisi Keempat). MC Graw Hill
- Graham Solomons t.W., Craig b. Fryhle. (2011). Kimia organik. (10th Edisi.). Wiley Plus.
- Carey f. (2008). Kimia organik. (Edisi keenam). MC Graw Hill.
- Morrison dan Boyd. (1987). Kimia organik. (Edisi Kelima). Addison-Wesley Iberoamericana.
- Metler Toledo. (s.F.). Reaksi sintesis. Pulih dari: mt.com
- Helmestine, Anne Marie, Ph.D. (27 Ogos 2020). Penerangan tindak balas sintesis ditambah peperiksaan. Diperolehi daripada pemikiran.com
- Wikipedia. (2020). Sintesis kimia. Diperoleh dari: dalam.Wikipedia.org
- Danielle Reid. (2020). Reaksi Sintesis: Definisi, Formula & Contoh. Kajian. Pulih dari: belajar.com

