Ciri -ciri dan contoh tindak balas exergonik

- 1933
- 225
- Julius Dibbert
A Reaksi exergonik Ia adalah salah satu yang berlaku secara spontan dan, secara umum, disertai dengan pelepasan tenaga, sama ada dalam bentuk haba, cahaya atau bunyi. Apabila haba dibebaskan, dikatakan bahawa kita menghadapi reaksi eksotermik dan exergonic.
Itulah sebabnya istilah 'eksotermik' dan 'exergonic' keliru, menjadi tersilap dianggap sebagai sinonim. Ini kerana banyak tindak balas eksotermik juga exergonic. Oleh itu, jika detasmen panas dan cahaya yang besar diperhatikan, seperti asal api, dapat diandaikan bahawa ia terdiri daripada reaksi exergonik.
 Pembakaran Kayu adalah contoh eksotermik dan pada masa yang sama reaksi exergonic. Sumber: Pixnio.
Pembakaran Kayu adalah contoh eksotermik dan pada masa yang sama reaksi exergonic. Sumber: Pixnio. Walau bagaimanapun, tenaga yang dikeluarkan boleh disedari dan tidak begitu mengejutkan. Sebagai contoh, medium cecair boleh memanaskan sedikit dan belum menjadi akibat daripada reaksi exergonik. Dalam beberapa tindak balas exergonik yang berlalu terlalu perlahan, kenaikan suhu terendah tidak diperhatikan.
Titik pusat dan ciri jenis tindak balas termodinamik ini adalah penurunan tenaga bebas Gibbs dalam produk berkenaan dengan reagen, yang diterjemahkan ke dalam spontan.
[TOC]
Ciri -ciri tindak balas exergonik
Rajah Umum
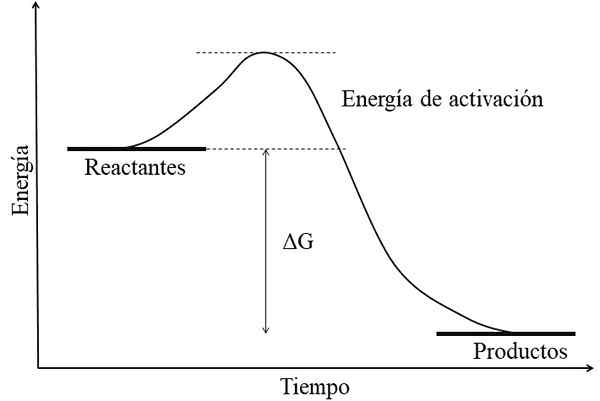 Rajah tenaga untuk reaksi exergonik. Sumber: Gabriel Bolívar.
Rajah tenaga untuk reaksi exergonik. Sumber: Gabriel Bolívar. Ciri utama reaksi exergonik adalah bahawa produk mempunyai tenaga bebas GIBSS lebih rendah daripada reaktan atau reagen (imej unggul). Fakta ini biasanya dikaitkan dengan produk secara kimia lebih stabil, dengan pautan yang lebih kuat, struktur yang lebih dinamik atau lebih banyak keadaan "selesa".
Oleh itu, perbezaan tenaga ini, ΔG, adalah negatif (ΔG < 0). Al ser negativa, la reacción en teoría debe ser espontánea. Sin embargo, otros factores también definen dicha espontaneidad, como lo son la energía de activación (la altura de la colina), la temperatura, y los cambios de entalpía y entropía.
Boleh melayani anda: sistem homogenSemua pembolehubah yang bertindak balas terhadap sifat fenomena atau tindak balas kimia yang dipertimbangkan, membolehkan untuk menentukan sama ada tindak balas akan menjadi exergonik. Dan ia juga akan dilihat bahawa ia tidak semestinya harus menjadi reaksi eksotermik.
Apabila tenaga pengaktifan sangat tinggi, reaktan memerlukan bantuan pemangkin untuk mengurangkan halangan tenaga tersebut. Itulah sebabnya terdapat tindak balas exergonik yang diberikan pada kelajuan yang sangat rendah, atau yang tidak berlaku sama sekali.
Penurunan tenaga bebas dalam sistem
Ekspresi matematik berikut merangkumi apa yang dikomentari di atas:
ΔG = ΔH - TΔS
Istilah ΔH adalah positif jika ia adalah tindak balas endotermik, dan negatif jika ia adalah eksotermik. Sekiranya kita mahu ΔG menjadi negatif, istilah TΔS mestilah sangat besar dan positif, supaya apabila menolak ke ΔH, hasil operasi juga negatif.
Oleh itu, dan ini adalah satu lagi ciri khas tindak balas exergonik: mereka menyiratkan perubahan besar dalam entropi sistem.
Oleh itu, dengan mengambil kira semua terma, kita boleh hadir sebelum reaksi exergonik tetapi pada masa yang sama endothermic; iaitu, dengan ΔH positif, suhu yang sangat tinggi, atau perubahan entropi besar.
Kebanyakan tindak balas exergonik juga eksotermik, kerana jika ΔH adalah negatif, dan dengan menolak satu lagi istilah yang lebih negatif, kita akan mempunyai ΔG dengan nilai negatif; Kecuali Tδs adalah negatif (entropi turun), dan oleh itu reaksi eksotermik akan menjadi endogonik (tidak spontan).
Adalah penting untuk menyerlahkan bahawa spontan reaksi (sama ada exergonic atau tidak), sangat bergantung pada keadaan termodinamik; Walaupun kelajuan yang berlalu, disebabkan oleh faktor kinetik.
Ia boleh melayani anda: perkara hidup: konsep, ciri dan contohSpontan reaksi exergonik
Apa yang telah dikatakan diketahui sejak reaksi exergonik adalah spontan, sama ada eksotermik. Contohnya, sebatian boleh larut dalam penyejukan air bersama -sama dengan bekasnya. Proses pembubaran ini adalah endotermik, tetapi apabila ia berlaku secara spontan, dikatakan bahawa ia adalah exergonic.
Reaksi eksotermik
Terdapat reaksi "lebih exergonic" daripada yang lain. Untuk mengetahui, ungkapan berikut harus di tangan:
ΔG = ΔH - TΔS
Reaksi yang paling exergonic adalah yang secara spontan diberikan kepada semua suhu. Iaitu, tanpa mengira nilai T dalam ungkapan sebelumnya, ΔH adalah negatif dan ΔS positif (ΔH 0). Oleh itu, mereka adalah tindak balas yang sangat eksotermik, yang tidak bercanggah dengan idea awal.
Terdapat juga tindak balas eksotermik di mana entropi sistem berkurangan (ΔS < 0); tal como sucede en la síntesis de macromoléculas o polímeros. En este caso, son reacciones exergónicas solamente a bajas temperaturas, ya que de lo contrario el término TΔS sería muy grande y negativo.
Reaksi endotermik
Sebaliknya, terdapat tindak balas yang hanya spontan pada suhu tinggi: apabila ΔH positif dan ΔS positif (ΔH> 0 dan ΔS> 0). Kami bercakap mengenai tindak balas endotermik. Itulah sebabnya keturunan suhu boleh berlaku secara spontan, kerana mereka membawa peningkatan entropi.
Sementara itu, terdapat tindak balas yang tidak sama sekali: apabila ΔH dan ΔS mempunyai nilai positif. Dalam kes ini, tidak kira apa suhu, tindak balas tidak akan berlaku secara spontan. Kami bercakap kemudian, dari reaksi endary yang berakhir.
Boleh melayani anda: penyebaran fasaContoh tindak balas exergonik
Kimia biasanya dicirikan oleh letupan dan cemerlang, jadi diandaikan bahawa kebanyakan reaksi adalah eksotermik dan exergonik.
Pembakaran
Reaksi exergonik adalah pembakaran alkana, olefin, hidrokarbon aromatik, gula, dll.
Oksidax logam
Begitu juga, pengoksidaan logam adalah exergonic, walaupun mereka lulus lebih perlahan.
Reaksi katabolik organisma
Walau bagaimanapun, terdapat proses lain yang lebih halus, yang juga sangat penting dan sangat penting: reaksi katabolik metabolisme kita. Di sini makromolekul menguraikan yang bertindak sebagai takungan tenaga, membebaskan diri mereka dalam keadaan panas dan ATP, dan terima kasih yang mana badannya melakukan banyak fungsinya.
Yang paling lambang tindak balas ini adalah pernafasan selular, bertentangan dengan fotosintesis, di mana karbohidrat dengan oksigen "dibakar" untuk mengubahnya menjadi molekul kecil (CO2 dan h2O) dan tenaga.
Yang lain
Antara reaksi exergonik yang lain kita mempunyai penguraian letupan triyoduro nitrogen, atau3; penambahan logam alkali air, diikuti dengan letupan; sintesis polimer resin etoksilasi; asid-asas neutralizations dalam larutan akueus; dan reaksi kemoterapi luminescent.
Rujukan
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (8th ed.). Pembelajaran Cengage.
- Walter J. Moore. (1963). Kimia Fizikal. Dalam kinetik kimia. Edisi keempat, Longmans.
- Iran. Levine. (2009). Prinsip Fizikokimia. Edisi Keenam, halaman 479-540. MC Graw Hill.
- Wikipedia. (2020). Reaksi exergonik. Diperoleh dari: dalam.Wikipedia.org
- Helmestine, Anne Marie, Ph.D. (16 September 2019). Reaksi dan Proses Endergonik vs Exergonik. Pulih dari: Thoughtco.com
- Reaksi Exergonik: Definisi & Contoh. (18 September 2015). Pulih dari: belajar.com
- Akademi Khan. (2018). Tenaga bebas. Pulih dari: Adakah.Khanacademy.org
- « Formula tenaga mekanikal, konsep, jenis, contoh, latihan
- Penggunaan lestari untuk apakah kegunaan, kepentingan, tindakan, contoh »

